与张峰同为麻省理工学院与哈佛大学Broad研究所主席兼主任Eric Lander在1月14日的《Cell》杂志上发表了一篇观点文章,简要介绍了精密基因编辑技术CRISPR背后的发展史,以及那些做出过突出贡献的人。然而,一石激起千层浪,一些批评者对此提出了激烈的反对意见。加州大学伯克利分校的Jennifer Doudna正与张锋及同事们陷入一场专利纠纷中,看到此文后,她在PubMed Commons网站上炮轰Lander,称他的描述“与事实不符”,Lander并未核实在关于她的实验室以及实验室与其他研究人员交往的描述,且在文章发表前也未征得她的同意。以下为英雄谱译文及精译版。
CRISPR-Cas9 的基因组编辑技术给整个学术界和工业界带来革命性的变化,随之而来的还有CRISPR专利之争。然而,我们知道一项科学技术的发展不是一蹴而就的,往往要经历了前后多辈及多个团队的努力才能有所突破。
科学家报告说,CRISPR技术可实现精确高效的在活的真核细胞中进行基因组编辑,从那时开始,这项技术像风暴一般席卷科学界,有数以千计的实验室在用它进行生物医药或者农业方面的研究。而这所有的一切都开始于一项微生物的研究……
古微生物实验的惊奇发现
故事发生在西班牙的科斯塔布兰卡,Francisco Mojica在当地的一个实验室研究古微生物。他发现培养基中的盐浓度影响着限制酶切断该微生物基因组的方式,他决定试着改变这些片段的特征。在他检查的第一个DNA片段中,发现了一个令人惊奇的结构,多份近乎完美的回文结构,重复着30个碱基序列,由大约36个碱基间隔开。之前没有任何微生物是这样的。一开始这个现象被称为短规则间隔重复(SSR),后来在Mojica的建议下,它被叫做Clustered Regularly Interspaced Palindromic Repeats(CRISPR)。
但依照Mojica的假说,CRISPR能够参与基因调控、复制子分区、DNA修复以及其他许多功能。但现在大多数的假设都鲜有证据,还有一些被证明是错误的。
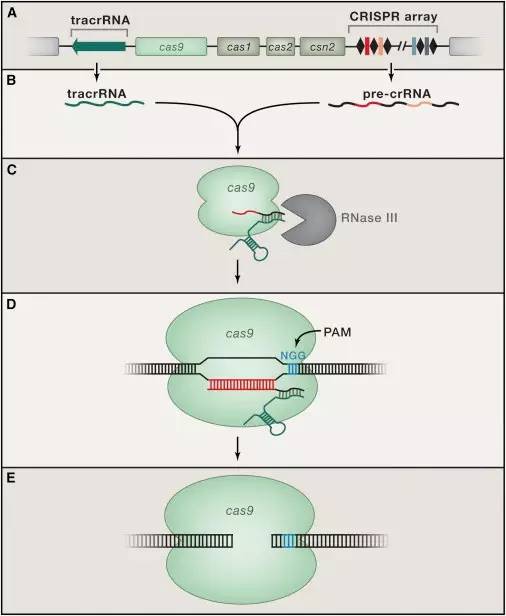
荷兰科学家与编程CRISPR
John van der Oost是一位荷兰科学家。他和他的同事们将大肠杆菌CRISPR系统插入另一株大肠杆菌中。这让他们得到了一个5个Cas蛋白的复合物,称为Cascade。通过单独的敲除每一个组件,他们发现Cascade需要切割很长的前体DNA,要从CRISPR基因转录到61个核苷酸长度的CRISPR RNA (crRNAs)。他们又克隆和测序了一组与Cascade共纯化的crRNAs,结果发现所有的序列都开始于最后8对碱基的重复序列,后面跟着完整的碱基间隔和下个重复区域,这一发现证实了重复的回文序列会导致crRNA二级结构的形成。
为了证明crRNA序列对CRISPR的影响,他们准备创造第一个人造CRISPR阵列,将CRISPR编入λ噬菌体的4个基本基因。正如预想的一样,搭载着CRISPR序列的菌株对λ噬菌体产生了抵抗,这也是第一次直接编程CRISPR。这个结果也暗示了CRISPR的作用目标并不在RNA,而是DNA。
CRISPR“瞄准”DNA的芝加哥学者Marraffini
芝加哥大学学者Luciano Marraffini也确信CRISPR无法通过RNA干扰发挥作用,因为这个机制实在是效率太低,无法克制噬菌体传染时候的爆发式增长。所以他推测,CRISPR肯定是像限制性内切酶那样切割DNA。
Marraffini通过分子生物学的方法,用CRISPR系统修改目标质粒中的内斯基因,在其序列中插入一个自我剪接的内含子。如果CRISPR的目标是mRNA,这项改变就不会产生影响,因为内含子序列会被剪切掉;如果CRISPR的目标是DNA的话,就会产生干扰,因为碱基间隔会不再匹配。结果很清楚:CRISPR“瞄准”的是DNA。Marraffini认为,CRISPR基本上是一个可编程的限制性内切酶,他的论文是第一个明确地预测CRISPR可能在异源系统中被用于基因组编辑。
cRNA引导Cas9生成双链断裂的DNA
CRISPR一般来说是非常高效的,以至于根本无法观察到它入侵和破坏DNA的作用机制。Sylvain Moineau和他的同事们观察嗜热链球菌的质粒干扰,发现质粒的切割取决于Cas9核酸。当他们测序线性质粒,发现一个单一的精确末端切割的PAM序列。经过他们进一步的分析,发现在病毒DNA中切断的位置也是相对于PAM序列的地方。他们研究明确表明了,活性Cas9核酸酶能在特定的编码序列位置上精确地切割DNA。
在哺乳动物中的基因编辑
在20世纪80年代末,科学家们就发明了一种在活体细胞中改变哺乳动物基因的方法,包括在小鼠胚胎干细胞中的特定位置插入DNA,但这些方法都需要对目标进行选择和筛选,效率低下。
因为Marraffini和Sontheimer的论文明确了CRISPR是一个可编程的限制性内切酶,研究人员已经掌握了CRISPR切割特定基因位点的方法。接下来最大的问题就是,如何让CRISPR在哺乳动物的细胞中工作。相比微生物,哺乳动物的基因组是其1000倍,且在细胞核中的一个染色质结构中。因此在2012年9月,专家们对于编辑人类基因组还持着怀疑的态度。
张锋发现在哺乳动物细胞中,虽然缺少微生物中的核糖核酸酶III,也仍然可以处理crRNA。在2012年中,他提出一个稳健的三足鼎立结构,Cas9、tracrRNA和CRISPR阵列。针对在人类和小鼠基因组16个位点,可以高效准确的变异基因删除非同源末端连接,并通过同源重组修复模板插入新的序列。此外,多个基因可同时通过CRISPR阵列来编辑。在2013年1月3号的《Science》上出版了张锋第一篇哺乳动物基因组编辑的报告,它成为了该领域被引用最多的论文。
从2013年初开始,谷歌中“CRISPR”搜索量就一路飙升。在一年之内,研究人员报告了许多生物,包括酵母,线虫,果蝇,斑马鱼,小鼠和猴子使用CRISPR为基础进行基因组编辑。在人类治疗和农业中对其应用前景也开始关注,而且该技术甚至可用于“生产设计”婴儿。
这个故事给我们的启示是,医学上的突破往往是从完全不可预测的起源涌现。 CRISPR的早期英雄不是在寻求修改人类基因组,甚至是研究人类疾病,而只是因为他们旺盛的好奇心。
来源:解螺旋
2016-05-17