今天为大家细数一下内源性大麻素系统在神经系统中的重大发现。
神经系统中的“双刃剑”
魔鬼——神经毒作用
动物实验发现,长期给予大麻素药物将导致持久的认知功能缺陷。长期给予大麻素的老鼠,其海马的形态学发生了改变,包括神经元死亡、突触密度减少和锥体细胞树突长度的减少。这表明,长期给予大麻素将产生神经毒性作用。此外,THC对于培养海马神经元、神经胶质瘤细胞、皮质神经元细胞都具有毒性作用,并能抑制活体内神经胶质瘤细胞的生长。
“魔鬼中的天使”——神经保护
在神经系统中,大麻素系统能够决定神经元的命运,决定它们的存活与死亡!!!实验证实,当神经元受到损伤,如兴奋性中毒、外伤性脑损伤、脑缺血时,大麻素能够起到保护作用,研究表明,这些神经保护作用可能依赖于以下机制,包括:
1、减少细胞钙内流,抑制GABA神经递质;
2、抗氧化,抑制自由基形成;
3、诱导低温状态的产生;
4、抗炎作用;
5、大麻素能够抑制TNFα的释放。
研究表明,原代培养的鼠皮层小神经胶质细胞暴露于LPS时,能够显著地激活TNF-αmRNA的表达与释放。而内源性大麻素AEA和2-AG能够通过浓度依赖性途径抑制LPS诱导的TNF-α释放。AEA还能够抑制星形胶质细胞中内毒素诱导的NO和TNF-α的释放。此外,大麻素还被证实可通过诱导内皮素(ET-1)加重脑损伤的血管收缩产生抑制等多种功能,更多精彩等待大家一起挖掘!
接下来,我们一起回顾下内源性大麻素系统CB1与CB2在心血管疾病中的的“爱恨纠缠”——CB1 VS CB2的“拉锯战”。内源性大麻素及其受体在心血管系统中广泛分布,在心肌细胞、血管平滑肌细胞、内皮细胞和血管壁周围的神经纤维末梢以及某些血液中的细胞表达。在正常情况下,内源性大麻素在调节心血管功能中调节甚微,而在功能失调时其表达及影响非常显著。
氧化应激——“疾病的加速器”
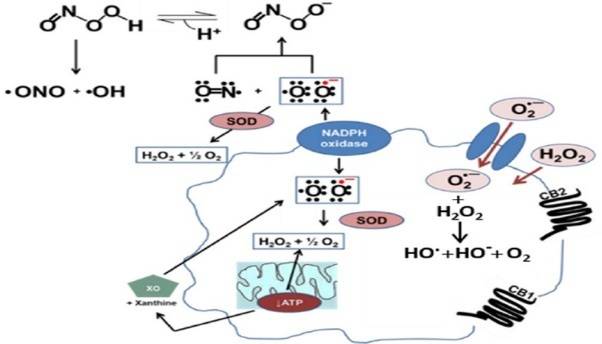
氧气是生命之本,其代谢产物ROS,在先天性免疫抵抗外源病生物中发挥重要作用。但过量的ROS则可导致大分子物质的损伤甚至细胞死亡。因此,过量ROS引起的氧化应激是细胞或组织损伤的重要介质,对于疾病的进展具有重要的作用。
代表性的ROS, 如O2·?和H2O2激活后参与的信号通路包括:参与细胞分化的ERK1/2信号通路,参与炎症及细胞死亡的JNK-MAPK通路,炎症因子及抗凋亡基因NFκB,调节代谢稳态的Akt、Ras、Rac和p38等。大量氧化物产生后所导致的病理结果是直接导致oxLDL及血管壁内膜的氧化生物分子大量增加。
大量实验证明,CB1和CB2 在动脉粥样硬化疾病中在炎症、氧化应激等环节呈现为相反的作用。越来越多的实验数据证明,包括由oxLDL 诱导的单核细胞的分化可导致CB1和CB2表达平衡改变,以使CB1的表达呈优势。内皮细胞中的CB2活化对于动脉粥样硬化早期进展及减轻炎症反应、减少活化。冠状动脉内皮细胞上的CB1活后,可显著诱导ROS及非依赖的MAPK活化,甚至细胞死亡。巨噬细胞上的CB1被激活后,表现为可以上调CD36的表达水平及巨噬细胞/泡沫细胞内的胆固醇累积。且人巨噬细胞的CB1受体活化与通过p38 MAPK信号通路链接产生ROS、TNFα及MCP1[1]。
炎症——“万病之始”
CB1与 CB2 具有相近的亲和性,但功效却与CB1相反!CB2 活化可以通过抑制巨噬细胞的募集阻断动脉粥样硬化斑块的进展,减弱CB1、减弱氧化应激及梗死心肌组织内的中性粒细胞的浸润。巨噬细胞内oxLDL积聚后导致巨噬细胞分泌的2-AG迅速增加。2-AG与免疫细胞表面的CB2受体结合激活Gi/o,进而抑制Rap1的促炎效应及AC下游的信号通路,最终减少ROS的产生。
由此可见,2-AG代偿性的表达增加进而通过激活CB2受体,最终形成动脉粥样硬化的保护效应。有研究发现,体外给予非选择性CB1/CB2受体激动剂处理,结果发现:在不增加CB1受体表达的情况下,减弱oxLDL诱导的ROS的产生及TNFα分泌。由此可见,大麻素可能作为动脉粥样硬化过程的一个重要靶点[2]。

参考文献:
1.Mach F, Steffens S: The role of the endocannabinoid system in atherosclerosis. Journal of neuroendocrinology 2008, 20 Suppl 1:53-57.
2.Matthews AT, Ross MK: Oxyradical Stress, Endocannabinoids, and Atherosclerosis. Toxics 2015, 3(4):481-498.
来源:解螺旋
2016-05-23