科研界有这样一种“浑然天成”的风气:追新兴事物、追研究热点,这本无可厚非,但其中难免混着一些亦步亦趋者。比如环状RNA(circRNA)刚在CNS等刊物上大放异彩,他就磨拳擦掌了,但一旦问起要研究circRNA什么功能、打算如何下手、有没有MiRNA或者其他RNA研究基础的时候就呈口吐白沫状。要知道比起免费午餐的虚无,更没有不打好基础知识就能研究透彻的机制。

circRNA:几十年来一直被当作剪切错误
早在几十年前就有科学家发现了具有高度热稳定性的circRNA,那为何长久以来它一直在科研冷宫?说白了,还是因为之前的技术和科研思维及知识储备跟不上。比如环状RNA很难与其它RNA区分开、早期RNA测序的分析算法会过滤掉环状RNA的标志性序列等,这些技术和方法学问题导致环状RNA一直被视为是遗传意外或者实验人为因素。
而最近四五年来,二代测序等技术经常把它从冷宫带出来散散步,展露下美妙的身姿,科学家们才开始想到:circRNA原来这么普遍,它竟然还具有组织特异性,不会有啥惊天动地的功能吧?于是乎,circRNA能够通过不同途径影响基因表达,有效扩展真核细胞转录组多样性和复杂性的作用就被挖了出来,它也从科研冷宫进入RNA正殿。这个全新的研究领域可谓是在短时间内得到了飞速的发展······
神奇的circRNA功能
1. circRNAs作为miRNA海绵,抑制miRNA与靶基因结合
这个功能很简单,你只要看一个最有典型代表的例子:circRNA CiRS-7就可以明白了,CiRS-7具有超过60个miR-7的结合位点,从而抑制了miR-7与靶基因CDR1的结合作用。
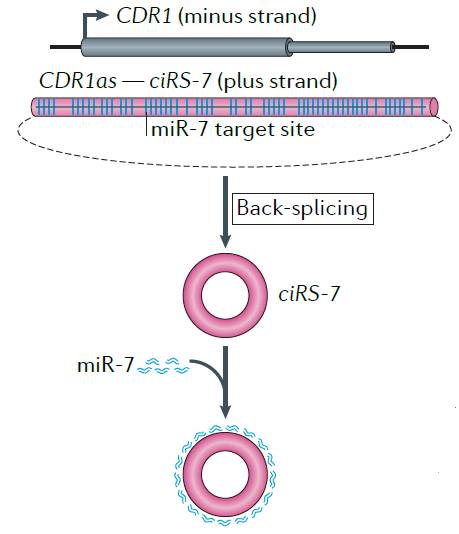
环状RNACiRS-7作为miR-7 sponge的作用示意图
所以问题来了:为什么前期有miRNA研究基础的占优势?因为我们可以采取下面的思路快速进攻circRNA领域!
-
选一个在疾病模型中异常表达的A:某miRNA,确定其靶基因B(此为加速步骤,要知道miRNA的文章由于通货膨胀近年来研究同样的机制套路影响因子却越来越低啦,你手头有现成数据又想发高分文章的机会来了,而且circRNA的很多研究方法与miRNA是通用的)
-
预测具有A结合位点的sponge circRNA C
-
利用RIP、FISH等方法验证A和C的相互作用
-
确定C?→A?→B?的调控关系
-
单独C的生物学功能研究,即在该疾病模型中上下调C的表达验证是否对细胞等模型具有作用
-
然后,可以写文章了!

2. 调节基因的转录
尽管大部分的
circRNA都在细胞质中,滞留于细胞核中的circRNA也有其用意:调节基因的转录。经典例子:来源于ANKRD52基因第二个内含子区域的circRNA ci-ankrd52依赖于和该基因共同的RNA序列(橙色部分)来避免与内含子索套脱支。ci-ankrd52主要在细胞核中积累,并促进RNAPol II对ANKRD52基因的转录。

3. circRNA的生物合成过程影响基因剪接
真核细胞
circRNA来自mRNA前体(pre-mRNA)的反向剪接,这就意味着,在pre-RNA生成后有两个去路:常规剪接生成线性mRNA A,或者反向剪接+常规剪接生成circRNA B+选择性剪接后的线性mRNA C。而A、B、C的动态平衡,难道不又是个值得研究的机制么?
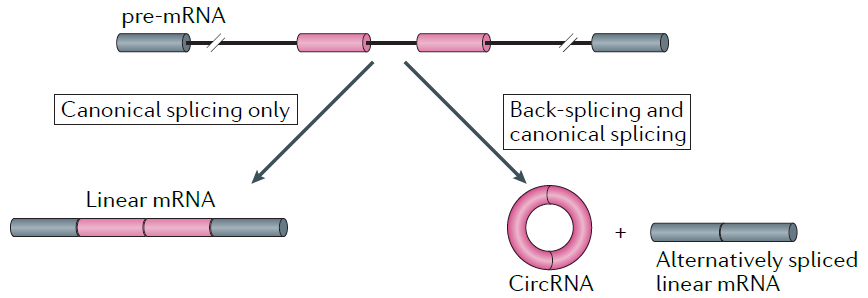
4. 作为疾病的生物标注物
circRNA是有组织特异性的,而关键是其疾病中的表达也和正常时有异,这就为它成为生物标志物奠定了很好的基础。已经有科学家对肝癌细胞外泌体circRNA测序发现,circRNA在外泌体中大量富集且于正常细胞相比差异很大,同时血清中肿瘤circRNAs的富集程度甚至与肿瘤的大小有关。
还对circRNA跃跃欲试的小伙伴,是不是该有些思路了呢?
参考文献:The biogenesis and emerging roles of circular RNAs,Chen Ling-Ling.
http://www.nature.com/nrm/journal/vaop/ncurrent/full/nrm.2015.32.html
来源:解螺旋
2016-06-07