同传统的基于限制性内切酶和DNA连接酶的克隆方法相比,新型体外重组克隆具有不依赖限制酶切位点和实现无痕克隆以及多片段的同时组装的特点。新型体外重组克隆主要包括不依赖连接克隆(LIC)和一步等温反应克隆。
· 不依赖连接克隆 ·
1不依赖连接克隆(LIC)
1990年,Charalampos Aslanidis和Pieter J.de Jong报道了一种不依赖于连接反应的克隆方法。其原理如图1所示:
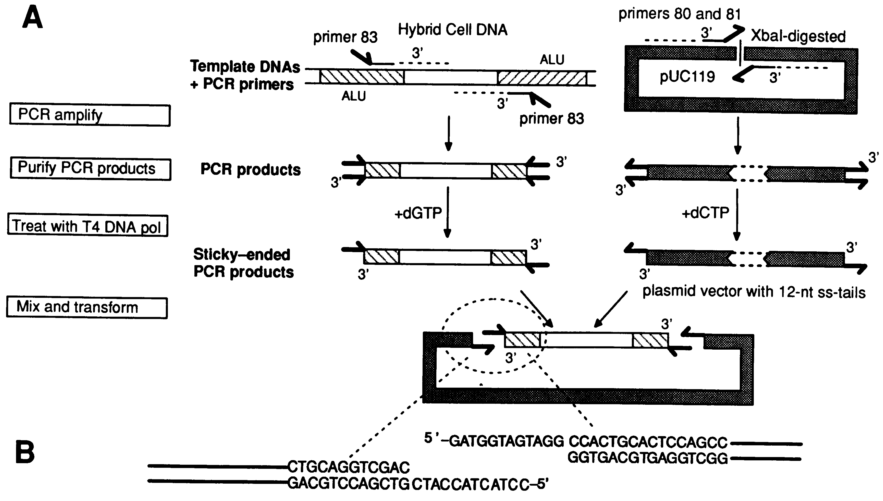
图1 LIC克隆示意图
-
用5’端带有一段“小尾巴”的特异性引物分别扩增目的DNA片段和载体;
-
然后通过T4 DNA聚合酶的3’-5’外切核酸酶活性在某单一成分dNTP(图1中处理目的片段时加dGTP,处理载体片段时加dCTP)存在的条件下分别消化PCR扩增得到的目的片段和线性载体,使其带有5’端悬挂的单链“小尾巴”(请注意,扩增目的片段的引物和扩增载体的引物所带的“小尾巴”是反向互补的,而且都是由三种脱氧核糖核酸组成的;由于在反应体系中添加了dGTP和T4DNA聚合酶,当消化目的片段两端至鸟嘌呤核苷酸-G时,反应就会停滞);
-
接下来将所得到的带有粘性末端的两种片段混合并进行变性和退火,就形成了图1(B)中所示的带有切口的环状DNA分子;将该环状DNA分子转化到大肠杆菌感受态细胞后,其体内的DNA修复机制会修复这种带有损伤的DNA分子,经过多轮体内复制我们就可以得到足量的目标质粒。
图1所示克隆方法中没有用到DNA连接酶,所以将这种克隆方法称为不依赖连接的克隆。它非常巧妙地避免了传统克隆方法对于特异性核苷酸序列(限制性酶切位点)的需求,但会引入至少12个核苷酸组成的“补丁”。2007年,不依赖序列和连接的克隆(SLIC)的出现,弥补了这一项缺陷,实现了LIC的无痕克隆。
2不依赖序列和连接的克隆(SLIC)
与LIC不同,SLIC克隆中目的片段和载体发生重叠部分序列是载体自身的序列。如图2所示:
-
用带有部分载体序列特异性引物扩增目的基因,用限制酶或PCR扩增得到线性载体;
-
接着用T4 DNA连接酶分别处理目的片段和线性载体一段时间,再加入某单一成分的dNTP终止反应,从而得到含有一段粘性末端的目的片段和线性(一般为20-30nt)载体;
-
然后将所得到的两种线性DNA片段混合、变性和退火,得到图2中带有缺口的重组中间体(SLIC克隆时还可以加入重组酶RecA以提高重组效率);
-
将中间体转化到大肠杆菌感受态细胞中;
-
经过培养,可以获得足量的目标质粒。
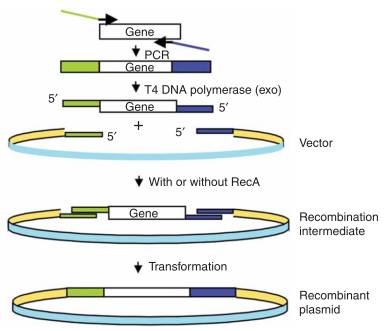
图2 SLIC克隆示意图
SLIC实现了无缝克隆和多片段组装的同时失去了LIC原有的一个优点,即SLIC在克隆过程中引入目的片段和线性载体两端的缺口是不可控的——我们很难准确的知道缺口的大小,这种不可控性造成SLIC在多片段组装时效率的降低。尿嘧啶特异性删除介导的克隆(USER-LIC)既能实现无缝克隆又能实现重叠DNA序列长度的可控。
3尿嘧啶特异性删除介导的克隆(USER-LIC)
USER-LIC主要是通过USER酶混合物(USER enzyme mix)特异性识别和删除扩增的双链DNA片段中的尿嘧啶核苷酸,从而实现重叠DNA序列长度的可控。USER酶混合物主要包括尿嘧啶DNA糖苷酶(uracil DNAglycosidase,UDG)和DNA 糖基化酶-裂解酶 Endo VIII(DNA glycosylase-lyase endo VIII);尿嘧啶DNA糖苷酶能够选择性地删除尿嘧啶碱基,而留下完整的磷酸二酯骨架;DNA 糖基化酶-裂解酶 Endo VIII能够打断无碱基位点两边的磷酸二酯键,释放脱氧核糖。USER-LIC克隆过程如图3所示:
-
用含尿嘧啶核苷酸的引物扩增目的片段和载体;
-
将得到的两种线性片段用USER酶混合物处理,使它们暴露互补的粘性末端;
-
将带有互补粘性末端的两种线性片段混合后转化到大肠杆菌感受态细胞中,经过筛选获得目标质粒。
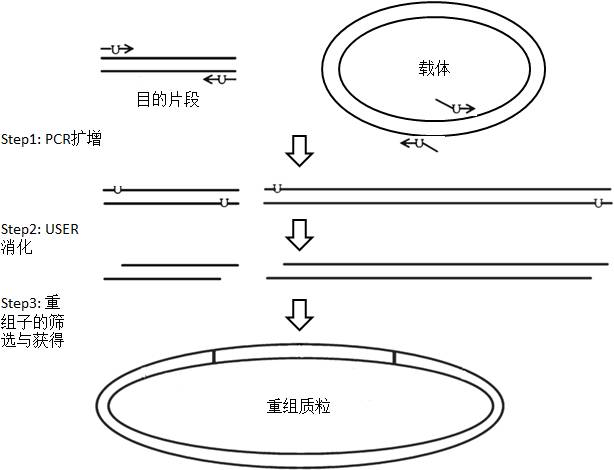
图3 USER-LIC克隆示意图
USER-LIC克隆也存在一些局限:
-
由于尿嘧啶只能加在引物的5’端,所以其只能产3’方向突出的粘末端;
-
线性载体片段只能通过PCR获得;
-
尿嘧啶的存在能够影响大多数具有校正活性DNA聚合酶的延伸效率,只有PfuCx等少数DNA聚合酶能够满足此类PCR的需求,但它们是昂贵的。
· 一步等温反应克隆(OSIAM) ·
前文提到的LIC系列克隆方法都要经历线性片段获得、粘性末端暴露和带有粘性末端片段的变性和退火等多个步骤,操作繁琐。一步等温反应克隆能够在一个反应体系中实现从粘性末端暴露到片段组装的流程。其原理如图4所示:
-
获得带有同源末端的目的片段和线性载体;
-
将两种片段混合并加入酶混合液(该酶混合液由三种酶组成,T5外切核酸酶消化产生粘性末端,在反应温度下,T5外切核酸酶逐渐失活;Phusion DNA聚合酶在量片段末端退火后填补缺口;TaqDNA连接酶连接切口),50℃进行反应;
-
将所得的产物转化到大肠杆菌感受态细胞中,筛选得到目标质粒。

图4一步等温反应克隆示意图
一步等温反应可以说是SLIC的升级版,只是其中用到了DNA连接酶,所以我们单独归为一种,它极大的简化了体外重组克隆的程序。
文中所介绍的几种新型的体外重组克隆方法各有特点(表1),我们可以根据我们的目的及手中的材料合理的选择。
|
方法 名称 |
所用的特殊酶 |
同源末端长度(bp) |
优点 |
不足 |
|
LIC |
T4 DNA聚合酶 |
12 |
不依赖限制酶识别位点和连接酶 |
会留下至少12bp“补丁” |
|
SLIC |
T4 DNA聚合酶、RecA(选用) |
20-30 |
不依赖限制酶识别位点和连接酶,DNA片段无痕组装 |
单链悬挂端的长度不可控 |
|
USER-LIC |
PfuCx、USER mix |
8-13 |
不依赖限制酶识别位点和连接酶,DNA片段无痕组装,单链悬挂端的长度可控 |
只能产生3’方向的突出末端,对扩增目的基因的DNA聚合酶有特殊要求,使用的酶较多、成本较高 |
|
OSIAM |
T5外切核酸酶、 Phusion DNA聚合酶、 TaqDNA连接酶 |
40-300 |
不依赖限制酶识别位点,DNA片段无痕组装,可组装的DNA片段总长达数百Kb |
使用的酶较多、成本较高 |
表1. 几种体外重组克隆方法的比较
要强调两点:
1.这里所介绍的体外重组克隆方法都能实现多片段的一步组装;
2.现在许多生物制剂公司(如Lifetech,Takara)都推出了相应的体外重组克隆试剂盒,极大方便了我们的克隆工作。分子生物学家对新型体外重组克隆方法进行完善和创新的脚步从未停止。Guo-Qiang Chen和其同事于2013年发表了另一种改进型的LIC克隆—NE-LIC。这是一种通过内切核酸酶实现低花费产生可控长度单链DNA重叠区的克隆方法。我们相信,分子克隆将来会成为我们生物学研究中很小的一部分。
参考文献
1. Charalampos Aslanidis , P. J. d.J. Ligation-independent cloning of PCR products (LIC-PCR). Nucleic Acids Research 18,6069-6074 (1990).
2. Aslanidis C1, d.J. P., Schmitz G. Minimal length requirement of the single-stranded tails forligation-independent cloning (LIC) of PCR products. PCR Methods Appl. 4,172-177 (1994).
3. Wang, R. Y.,Shi, Z. Y., Guo, Y. Y., Chen, J. C. & Chen, G. Q. DNA fragments assemblybased on nicking enzyme system. PLoS One8, e57943, doi:10.1371/journal.pone.0057943(2013).
4. Annaluru, N. et al. Assembling DNA fragments by USERfusion. Methods Mol Biol 852, 77-95,doi:10.1007/978-1-61779-564-0_7 (2012).
5. Nour-Eldin, H.H., Hansen, B. G., Norholm, M. H., Jensen, J. K. & Halkier, B. A. Advancinguracil-excision based cloning towards an ideal technique for cloning PCRfragments. Nucleic Acids Res 34, e122, doi:10.1093/nar/gkl635(2006).
6. Gibson, D. G. et al. Enzymatic assembly of DNAmolecules up to several hundred kilobases. NatMethods 6, 343-345,doi:10.1038/nmeth.1318 (2009)
来源:解螺旋
2016-06-20