在淋病、梅毒和艾滋三大性病中,前两者现在都已经有了有效的治疗手段。在经过及时的治疗之后,对病人的生活影响很小。而艾滋病由于目前在全世界范围内仍缺乏根治HIV感染的有效药物,因此现在主要的治疗目标只是:最大限度和持久的降低病毒载量、提高生活质量、降低死亡率,可以说是个不治之症。如今,结合CRISPR技术人类对于艾滋的治疗除了药物抗病毒以外,开始向更深层的基因治疗迈进。在本月的CNS期刊中,就有三篇关于HIV的文章,都是从基因的层面进行分析。
HIV包膜三维结构HD出炉
3月4日的《Science》上刊登了美国斯克里普斯研究所拍摄的HIV Env三聚体处于自然状态下的高清无码结构图,这个蛋白主要负责识别和感染宿主细胞。这张图详细地绘制这种蛋白底部的脆弱位点图,以及能够中和HIV的抗体结合位点图。这种结构一直很难被捕捉到,因为它比较脆弱,在能够对获取它的图片之前,就已瓦解了。人们现在已经知道它的自然状态是什么样子,下一步就能研究疫苗应用。
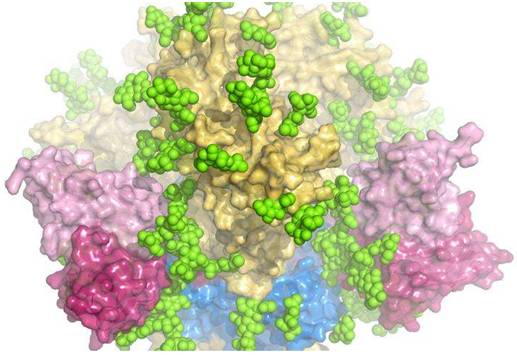
最理想的情况当然是抗体能够靶向作用于HIV的Env三聚体,即三个松散连接的蛋白(图中红黄蓝部分)。从HIV病毒包膜伸向外面,能够让该病毒与宿主细胞融合,从而感染它们。因为三聚体的结构是高度保守的,这就意味着同样的脆弱位点存在很多种HIV毒株中,作用于这些位点的抗体很可能是广谱中和抗体。但是,一种被称作多聚糖(图中绿色部分)的糖分子保护物阻止很多抗体达到这个区域。
所以,为了开发一种抵抗HIV的疫苗,这个结构图就非常重要了。科学家们通过这些多聚糖的结构图按图索骥,来揭示出这种保护物中存在的小漏洞,这样抗体就可能穿过这些小漏洞,从而中和这种HIV。
说起来简单,之前也提过HIV Env三聚体极其不稳定,这是使得科学家们很难捕捉到好的结构图片,从前的研究也只能获得截断的Env三聚体或通过突变而变得稳定的Env三聚体高分辨率结构图,一直以来,没有人能够观察到处于自然状态下的这种三聚体和它的多聚糖防御结构。在这个研究中使用了一种被称作低温电子显微镜的三维成像技术,从而能够获得原子水平的高分辨率结构细节。研究人员在HIV的包膜环境中提取和纯化这种脆弱的Env三聚体,并将它装载到这种电子显微镜中进行成像,所获得的图片包括比以往任何时候见到过的都要更加完整的Env三聚体结构图。
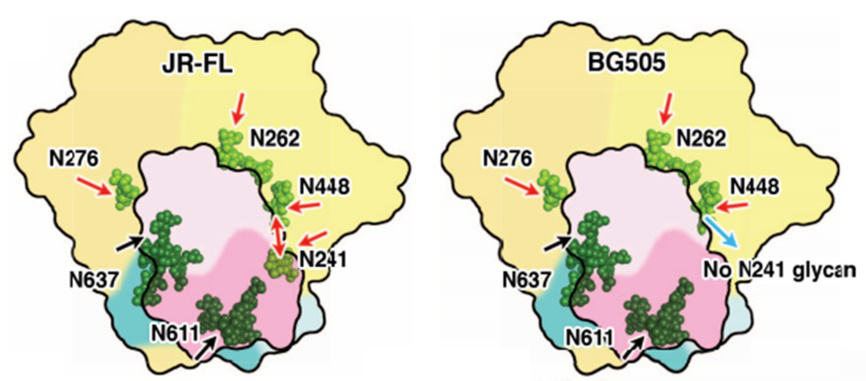
这些结构也证实这种Env三聚体是可塑性的,能够灵巧地改变它的形状。这种形状改变既是这种融合复合体的一种功能,同时也是一种躲避中和抗体反应的方法。这些结构图也包括非常详细的HIV广谱中和抗体PGT151敏感位点图(黑色箭头中的多聚糖与PGT151有高亲和力,红色箭头则是亲和时要客服空间障碍),除了靶向Env表面上的几种多聚糖之外,PGT151也能够结合到一种融合肽上而让HIV不能感染宿主细胞。
这些研究发现让研究人员更好运用这种多聚糖保护物所需的抗体特征,并且基于这项研究开发更加优越的候选疫苗。
参考文献:Lee J H, Ozorowski G, Ward A B. Cryo-EM structure of a native, fully glycosylated, cleaved HIV-1 envelope trimer.[J]. Science, 2016, 351(6277).
发现抵抗HIV的强效抗体
HIV疫苗的一个重要作用就是促进能够攻击HIV病毒的抗体产生(即使病毒持续发生突变)。在3月5日《Cell》上的一项研究中,研究人员在一名HIV感染者体内追踪到罕见的强效广谱中和抗体,并且确定了它的一系列结构从而表明它是如何形成的。这项研究能解决实验性HIV疫苗的一个关键问题,即疫苗如何能诱导广谱中和抗体产生,并利用一系列结构来观察中和抗体和病毒中发生的变化。

在6年前,研究人员就开始追踪一个在HIV感染几周内就被确诊的非洲人,这个非洲人在定期进行诊断的同时,提供血液样品给研究人员从而允许后者实时地研究HIV和体内免疫反应的共同进化。通过使用高分辨率电子显微镜和构建结构模型,研究人员能够观察这种结合到HIV包膜上的中和抗体,以及在这种中和抗体和HIV中发生的复杂结构变化。
HIV非常快速地发生突变,理解这种相互作用而结构变化就成了疫苗开发的一个重要部分。广谱中和HIV抗体是从慢性HIV感染病人体内分离出的,这就表示他们可能能够在健康人体内促进这些中和抗体产生以便抵抗这种病毒感染。
目前,这项研究所获得的发现将在模式动物体内进行测试,而开发一种有效疫苗的第二个重要因素就是理解体内免疫系统如何经常挫败广谱中和抗体开发。解决这个问题的研究正在开展中。
参考文献:Bonsignori M, Zhou T, Sheng Z, et al. Maturation Pathway from Germline to Broad HIV-1 Neutralizer of a CD4-Mimic Antibody.[J]. Cell, 2016.
人类“治愈”婴猴艾滋
俄勒冈州国家灵长类动物研究中心的科学家将婴猴暴露在SHIV(具有HIV包膜蛋白的嵌合猴病毒)中。感染后的24小时内,再用抗体治疗,能将病毒彻底清除。这项在《Nature Medicine》上的研究表明,给暴露在SHIV的婴猴进行抗体给药能够成功清除病毒,这给人类治愈艾滋病带来了很大的启迪。

HIV能通过哺乳和分娩进行母婴传播,同样的SHIV感染的非人灵长类动物也可以通过母乳喂养把SHIV传染给后代。对于人们来说,可以用抗逆转录病毒治疗、剖腹产分娩和配方奶粉喂养等各种方法阻断HIV-1的母婴传播,目前HIV的母婴传播率已从1994年的25%下降到2%,即便如此,每年仍有大约20万名儿童感染艾滋病,主要是在治疗不成熟的发展中国家。
研究人员在婴猴暴露于病毒后第1,4,7和10天进行皮下注射中和单抗。没有抗体治疗的婴猴可观察到SHIV在暴露第一天就在多种组织中发现。相反,在第一针注射后就即刻产生影响。感染早期强效抗体的注射能在第14天将病毒完全清除。即使用高敏感的方法也没有在婴猴体内任何组织中检测到病毒。研究表明:
(1)皮下注射的抗体能迅速分布于血液和组织中,在不同位置保持中和活性,
(2)抗体能有效清除病毒,与ART治疗的机制不同,ART是多种抗逆转录药物,能减慢HIV在体内的复制速度。
其他非灵长类的实验结果表示,感染三天后再进行抗逆转录病毒治疗过晚,无法阻止HIV 潜藏库的建立。研究人员推荐在妊娠最后一个月,分娩后的几天和母乳喂养期间进行抗逆转录病毒治疗治疗。但风险仍然存在,包括长期治疗的毒性,病毒耐药株的产生和分娩前的护理缺乏等问题。对HIV暴露的新生儿进行抗体治疗的临床试验已在美国和南非展开。之前已有临床一期实验在HIV-1阴性的成年人中表明抗体的安全性和良好的耐受性。
参考文献:Early short-term treatment with neutralizing human monoclonal antibodies halts SHIV infection in infant macaques, Nature Medicine, DOI: 10.1038/nm.4063
CRISPR清除人T细胞HIV-1
美国天普大学路易斯卡茨医学院的研究人员在Nature出版集团旗下的《Science Report》中发表了最新的研究成果。这项发现表明研究人员用CRISPR技术可以有效而安全地清除培养的人细胞DNA中的HIV-1病毒,并防止病毒进行进一步的复制与再感染。
治愈艾滋是HIV研究领域的终极目标。但当病毒已经整合进入CD4+ T细胞,清除病毒被证明是十分困难的。最近很多研究尝试重新激活HIV,目的是刺激免疫系统在被感染细胞中清除病毒,但目前这样的研究还没人成功。所以本次的研究人员采用了一种新的方法,用特别的基因编辑技术靶向HIV-1整合的基因组。方法包括一个能定位到T细胞基因组中HIV-1 DNA的导向RNA,一个剪切T细胞DNA链的核酸酶。只要核酸酶将HIV-1 DNA序列剪了出来,基因组的松散的一端可以通过细胞自有的DNA修复机制重新连起来。
早前,此团队就已成功将HIV-1的DNA从人体免疫细胞上移除,最近一期的研究更显示,清除过后的细胞,就不会再被HIV病毒感染。而以前的抗反转录病毒药物可帮助病患控制HIV的感染病情,但只要病患忘记或者是停止服用此药物,病毒就会自行开始复制,导致病情再度恶化。
研究的另一部分是拖把效应和毒性问题。使用深度全基因组测序方法,这是基因评估的金标准。研究人员分析了由引导RNA靶向的其他位置的突变率,排除了拖把效应和潜在的对细胞基因表达的附带影响。细胞活性和繁殖的研究证明,清除HIV-1 的细胞可以正常生长于发挥功能。
参考文献:Rafal Kaminski et al. Elimination of HIV-1 Genomes from Human T-lymphoid Cells by CRISPR/Cas9 Gene Editing, Scientific Reports (2016). DOI: 10.1038/srep22555
来源:解螺旋2016-06-27