蛋白质参与行使几乎所有的细胞功能。为了行使其特定的功能,蛋白质必须折叠成特定的结构。蛋白质结构研究可帮助对其功能机制的深入理解,也可帮助进行药物筛选及设计优化。
蛋白质生物化学功能主要有结合、催化、分子开关以及细胞骨架等。哺乳动物细胞中蛋白质超过一半是酶。
蛋白质结构的稳定性是其发挥生物功能必需的,三级结构由非共价和共价两类相互作用稳定,其中非共价相互作用为主。下表是稳定蛋白质结构的化学相互作用。
键名 | 键长 | 键能 |
共价键(C-C) | 共价键(C-C) | 356kJ/mol 610kJ/mol(C=C双键) |
二硫键 | 2.2埃 | 167kJ/mol |
盐桥 | 2.8埃(<3.4埃) | 12.5-17kJ/mol 30kJ/mol(部分或全部包埋) |
氢键 | 3.0埃(<3.4埃) | 2-6kJ/mol(水环境) 12.5-21kJ/mol(供体或受体带电荷) |
长程静电作用 | 可变 | (非极性环境中强,水环境中弱) |
范德华作用 | 3.5埃(<4埃) | 4kJ/mol 4-17kJ/mol(蛋白内部) |
蛋白质结构的柔性是其发挥功能必需的:蛋白质结构柔性对于其配体结合和催化是必需的;蛋白质三级结构的柔性使其能够对配体进行调适;不同蛋白质根据其功能具有不同程度的结构柔性。值得注意的是蛋白质晶体结构是时间和空间的平均,是静态的,而生理条件下蛋白质结构往往是一个巨大的构象集合,是动态性的。
分子识别和催化均依赖于结构互补性,分子识别依赖于蛋白质三级结构形成的特定微环境,而催化反应则依赖于结合位点的特定微环境。蛋白质结合生物大分子的位点位于蛋白表面上,形状可为凹,凸或平,而蛋白质结合小分子的位点通常是裂缝,口袋或洞;催化位点通常位于结构域或者亚基界面上。配基结合位点通常具有更多的疏水残基暴露在分子表面;小分子结合位点通常是凹陷的并具有部分疏水性;以疏水补丁为主介导的弱相互结合使得蛋白可以交换伙伴(信号转导);决定结合力的结构元素通常是不具有方向性的疏水相互作用;决定结合特异性的结构元素通常是具有方向性的,如氢键等。
鉴定蛋白质结合位点的策略:蛋白质结合位点有时候可通过对其三维结构的计算分析得到(GRID/MCSS)。实验方法测定蛋白质结合位点比计算分析准确,定点突变可以鉴定与结合或催化相关的氨基酸,DOCK可以模拟蛋白质与配体之间的结合(点此查看分子对接教程)。
蛋白质是由单个或多个结构域组成的,结构域/折叠花样的总数是有限的。蛋白结构的模块化本质允许一级序列存在插入或删除。一般来说,结构域与功能一一对应(如Kinase),但并不总是如此(如TIM桶),类似的结构可具有不同的功能,不同的结构可具有相似的功能。
蛋白质结构与功能研究的技术路线如下:
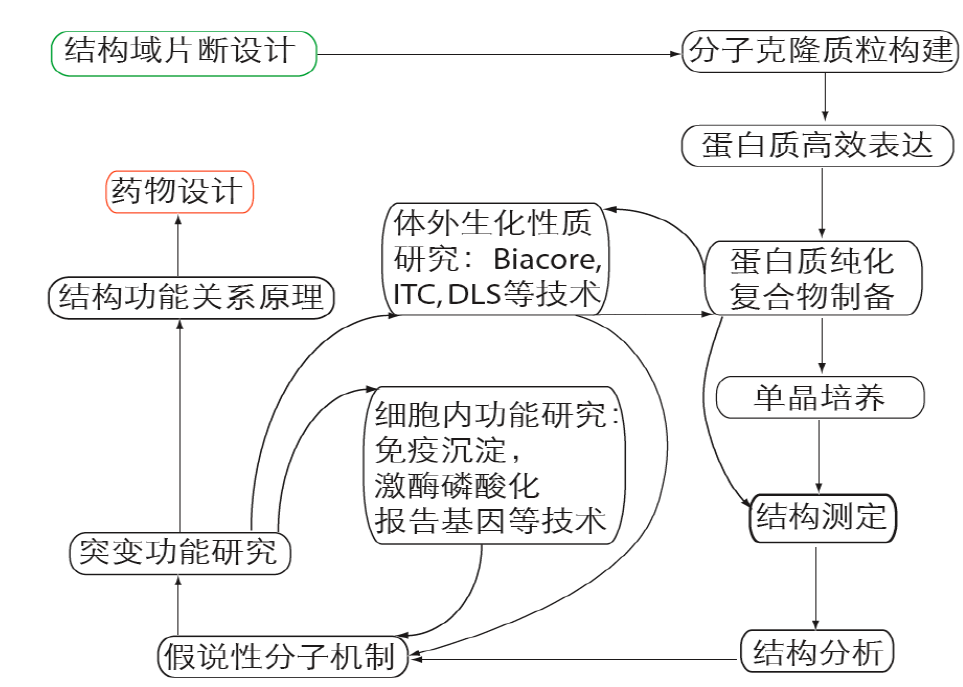
对整个技术路线,我们挑选其中的几个来讲一讲。首先就是蛋白结晶片段的选取,前面讲过,一般来说,蛋白质结构域与功能一一对应。因此,为了降低整个项目的难度(多个结构域会增加蛋白制备难度和结晶难度),通常会按照结构域选取蛋白质片段进行重组蛋白制备及结晶。这就涉及到蛋白质结构域边界如何确定的问题。目前的主要方法是限制性酶解:比如将重组蛋白与trypsin孵育,取不同孵育时间的样品进行SDS-PAGE鉴定。一般来说,独立的结构域具有结构上的稳定性,能抵抗住蛋白酶酶解作用,这样我们从SDS-PAGE图上就可以观察到一条稳定条带,然后通过质谱、N端测序等手段确定该片段的起始-终止位置。然后就以这个片段构建克隆,制备重组蛋白,进行后续的一系列实验。
在完成蛋白质结构测定之后,就需要对蛋白质结构进行分析。通过结构,我们可以找到酶的活性位点、分子表面电荷与形状、与配体相互作用界面以及构象变化。这些特征为我们了解功能作用模型和生理与病理机制提供了可能。基于上述结构特征,我们可以提出假说性的分子机制,然后基于结构分析的突变与野生型对比,我们可以对机制进行修正和完善。具体来说,我们可以对突变型和野生型进行生化分析(活性及相互作用);细胞学分析(活性及相互作用对定位及细胞表型影响);遗传学分析(果蝇或小鼠表型变化及相关信号通路)。
Souce: 纽普生物 2018-03-18