目前单克隆抗体制备技术有杂交瘤技术、EBV 转化B 淋巴细胞技术、噬菌体展示技术、转基因小鼠技术以及单个B 细胞抗体制备技术等。
传统的鼠杂交瘤单克隆抗体技术的基本过程是将来源于免疫接种过的小鼠的B 细胞与骨髓瘤细胞融合,继而筛选出既能无限增殖又能分泌抗体的鼠杂交融合细胞,但是这种方法得到的鼠源抗体免疫原性高、半衰期短,往往临床疗效不显著。即使是对鼠源单克隆抗体进行完全人源化的基因工程改造,也不可能完全消除鼠源单抗的免疫原性,对临床疗效的改善依然有限。
人杂交瘤技术是在鼠杂交瘤技术的基础上发展的一种抗体制备技术,这种方法是将免疫过的人或鼠B 细胞与人骨髓瘤细胞融合从而获得无限传代且能分泌抗体的杂交融合细胞,该技术虽然克服了鼠杂交瘤技术免疫原性等不足,但是仍有较多局限,如人骨髓瘤细胞系非常有限、细胞融合成功率低且容易造成染色体丢失等。
针对于以上缺陷,研究者利用EB 病毒 (Epstein-Barr Virus,EBV) 在体外能感染正常静止的B 细胞,使它们变成永生化的淋巴细胞系这一特性,制备分泌人单抗的杂交瘤细胞,即EBV 转化B 细胞技术。然而,EBV 转化B 细胞株不是恶性肿瘤细胞,较难克隆且抗体产量低,因而仍然没有得到广泛应用。
噬菌体展示技术是目前广泛应用的体外筛选人源抗原特异性抗体可变区基因的一种方法,噬菌体展示是将抗体DNA 序列插入到噬菌体外壳蛋白结构基因的适当位置,使抗体随噬菌体的重新组装而展示到噬菌体表面的生物技术。这种方法无需B 细胞培养过程、较为简单,但是得到的抗体并非在人体中表达,可能导致构象改变从而丢失抗原特异性,并且由于抗体重链和轻链随机组合,无法保持抗体重链轻链的天然配对。
除此之外,转基因鼠抗体制备技术在破坏鼠内源抗体基因后导入人抗体基因,进而用目标抗原免疫转基因鼠并在其体内表达人源抗体,这种方法得到的抗体产量和亲和力较高,但是鼠与人类免疫系统组成上的差异限制了其应用前景。
单个B 细胞抗体制备技术是一种体外克隆和表达单个抗原特异性B 细胞抗体基因技术,这种方法保留了轻重链可变区的天然配对,具有基因多样性好、效率高、全人源、需要的细胞量少等优势。
单个B 细胞抗体制备技术过程
1. 鉴定和分离单个B 细胞
细胞来源:外周血中分离浆细胞;外周血中分离单个记忆B 细胞;骨髓中分离前B 细胞。
在样品丰富的情况下,为提高特异性抗体得率,可以在分离B 细胞之前先通过密度梯度法,或流式细胞分选从外周血中粗分离B淋巴细胞,以ELISPOT 进行抗原特异性细胞丰度的评价,从而选择含抗原特异性抗体浓度较高的血样进行后续抗体制备。
单个B 细胞分离可分随机分离和抗原特异性分离,前者只需分离B 细胞,操作简单,适用于抗原特异性抗体浓度较高的血样,通常来自于疫苗接种者或患者,以尽量减轻后续抗体特异性鉴定的工作量。后者需分离抗原特异性B 细胞,操作较复杂,尤其适合抗肿瘤抗体、自身免疫抗体等特异性抗体含量较低的情况。
Table 1 Approaches of single B cell isolation
Approaches | Advantages | Disadvantages | |
Random isolation | Micromanipulation | Low equipment requirements Simple operation | Low efficiency Limited types of isolated cells |
Laser capture microdissection | High position accuracy Simple operation | Low efficiency Complicated process of sample preparation | |
Fluorescence-activated cell sorting | High accuracy and efficiency High degree of automation | Complicated operation High equipment requirements | |
Antigenselective isolation | Fluorochrome-labeled antigens via multiparameter | High accuracy and efficiency High degree of automation High-throughput and multiparameter Capability of isolating B cells at different stages | Complicated operation High equipment requirements |
Antigen-coated magnetic beads | High purity Mostly used in pre-isolation of fluorescence-activated cell sorting | High cost Limited bioactivities | |
Microengraving/Cell-based micro-array chip systems | High accuracy and efficiency Low cost Early and rapid identification of antibody-secreting cells | Complicated operation |
2. 扩增和克隆抗体基因
细胞分选时,通常需将单个B 细胞分至内含适量细胞裂解液、RNA 酶抑制剂和PCR 反应试剂的适当容器中,如96 孔板。由于单个细胞内RNA 含量少,适当的容器可以方便大批量操作、防止样品损失或交叉污染。另外,不同类型B 细胞抗体分泌能力差异明显,如抗体分泌B 细胞中抗体基因转录本含量远高于记忆B 细胞,因此从抗体分泌B 细胞中更容易扩增得到抗体基因。
通常从单个B 细胞中扩增未知抗体基因,需使用合适的引物进行巢式或半巢式逆转录PCR(Nested or semi-nested RT-PCR),该过程要求引物具有通用性、灵敏性、特异性,能避免非特异性扩增又能扩增出完整的抗体基因序列,因此合理设计引物序列至关重要。通常针对抗体重链轻链可变区不同前导序列设计前向引物的混合物,反向引物特异性互补于抗体恒定区。根据实验目的,如果分离和扩增不同同种型的抗体,反向引物则是特异性互补于各种同种型抗体恒定区的混合物。
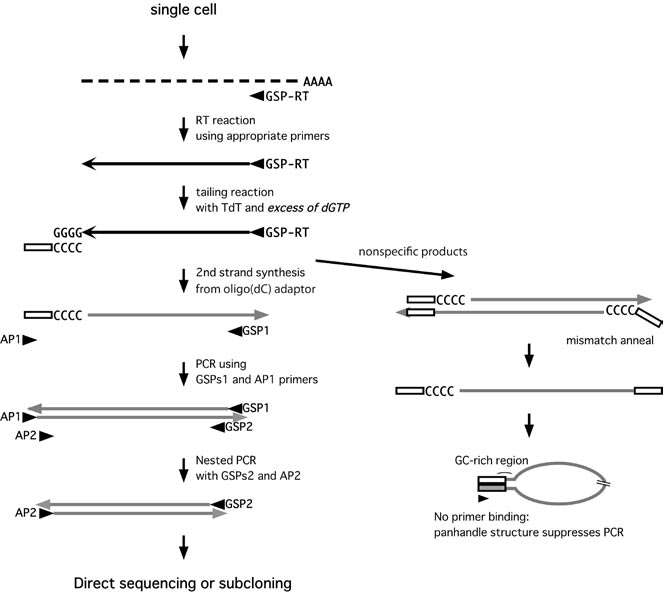
Ozawa 等通过5’ RACE (5’ rapid amplification of cDNA ends) 方法成功扩增出抗体基因编码框5’端的完整序列,该方法通过针对不同同种型抗体恒定区保守序列的特异性反向引物序列GSP 引物(Gene-Specific Primer)混合物, 直接从细胞中RT-PCR 合成cDNA 第一链,对第一链加多聚G尾后(通过末端脱氧核苷酸转移酶TdT实现),继续用一条带有下游巢式PCR 引物互补序列和多聚C 的前向引物AP 合成第二链,进而利用针对AP 和恒定区保守序列的特异性引物混合物进行两步巢式PCR,更加特异地扩增出目的基因。传统的5’ RACE 法扩增未知基因的细胞含量要求较高,Ozawa 提出的单个B 细胞5’ RACE材料要求少至仅需一个细胞,且可能扩增出多种前向引物混合物PCR 的方法无法扩增出的抗体基因,另外过程中无需纯化PCR 产物,省略了复杂的前向引物混合物,大大简化了反应体系。
备注:末端脱氧核苷转移酶 TdT是一种模板非依赖型DNA聚合酶,催化在寡核苷酸、单链和双链DNA的3’-OH重复添加脱氧核糖核苷酸。也就是说添加的这段序列是由我们给与的dNTP原料来决定的。
扩增出的抗体基因片段连接成scFv、scAb、Fab等形式,酶切将其构建到原核或者真核表达载体中。
3. 表达、筛选和鉴定抗原特异性抗体
鉴定抗体的抗原特异性和生物活性前需将携带有抗体基因的表达载体在相应系统中表达,最简单常用的是原核表达系统,如Escherichia coli,相较而言,真核表达系统尤其是哺乳动物细胞表达系统更有利于抗体的加工修饰,其产物的生物活性可靠性更高,常用的有HEK293和CHO等细胞系。
Souce: 纽普生物 2018-06-01