分辨率在结构解析中,是对应于最小可观察特征的距离:如果两个对象比该距离更近,它们将显示为一个组合的blob,而不是两个单独的对象。截止目前(2019年11月),PDB数据库中最高分辨率为0.48埃,该结构ID为:5D8V和3NIR。下图1中展示了不同分辨率结构中的酪氨酸,在高分辨率的时候,每个原子都有一个blob,而低分辨率的时候blob和blob之间会连在一块。
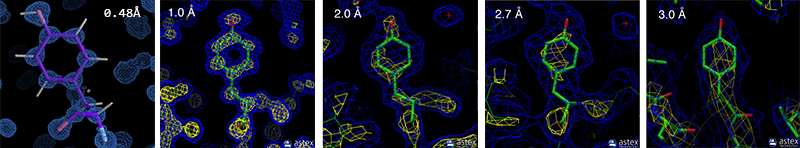
图1
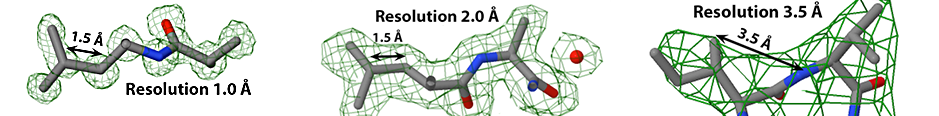
图2
用x射线晶体学或低温电子显微镜进行结构测定可得到电子密度图(图2绿色所示)。在电子密度图的指导下,原子模型(如图所示)被建立起来。
在X射线晶体学中,分辨率是在衍射图中分辨的晶格面之间的最小距离。 较高的分辨率数值(例如4Å)表示较差的分辨率,而较低的数值(例如1.5Å)表示较高的分辨率。
截止2019年5月19日,PDB数据库中X射线晶体学结构中分辨率的中值为2.05埃。作为对比,碳原子的范德华直径为3.4-3.7Å,共价碳-碳键的长度为1.5Å。我们提供的结构生物学服务中,一般承诺分辨率不高于2.9埃。
如果大分子的某些部分在晶体中的排列次序比其他地方的要差,那么这些地方的分辨率会比较差,“晶体的分辨率”其实是代表最有序的部分的分辨率。因此我们经常可以看到蛋白的某些loop区在结构中缺失,就是因为这些loop区柔性较大,造成分辨率较低,从而看不到或者仅能看到部分电子密度。
那么我们该如何解读分辨率呢?什么是高分辨率?什么分辨率较差?
我们给出以下快速指南:
1.2 Å,非常优秀,蛋白主链和绝大部分侧链都非常清晰,甚至某些氢原子都能被解析出来。
2.5 Å,良好,蛋白主链和一些侧链清晰
3.5 Å,OK,蛋白主链和大的侧链基本清晰
5 Å,不良,蛋白主链大部分清晰,侧链不清晰;
请记住,分辨率值表示晶体的“最佳”(最有序的)部分,而其他部分的质量可能更差。晶体学模型中每个原子的温度值(B因子)可以表明其电子密度图的清晰度。
什么限制了分辨率?
在大分子晶体中,晶体的有序度(“晶体的质量”)限制了X射线晶体学的分辨率。
理论上,分辨率受X射线波长(大约1Å)的限制,但实际上,可用晶体的质量决定了分辨率。从各种纯化的蛋白质制备而来的晶体中,有超过一半的晶体不是“原子分辨率”的,也就是说,这种紊乱太大而无法确定分子结构。晶体学家面临的最大挑战也许是获得衍射到“原子分辨率”的有序晶体。因此,每次收集衍射数据的时候,我们都会挑取好多颗晶体进行衍射测定,挑选分辨率最高的晶体数据进行后续结构解析。
衍射图的分辨率取决于晶体的有序性。如果它是高度有序的(原子在整个晶体中的位置都是确定的,且不随时间变化),则晶体将衍射至高分辨率。混乱程度越大(原子位置随时间而变化,或者一个晶胞的含量与另一个晶胞的含量不同),衍射图像的分辨率越低。衍射斑点的强度随着无序度的增加而下降。为了能够测量弱反射点,有时可以增加实验中使用的X射线的强度,增加检测器的曝光时间或灵敏度,或者增加晶体的尺寸。
分辨率越高,数据集中的衍射点越多。衍射点的数量跟分辨率三次方的倒数成正比,因此1.0Å数据集的衍射点数是2.0Å数据集中的衍射点数的八倍。
分辨率与结构质量的关系是什么?
衍射数据的分辨率越高,意味着测得的衍射点具有更小的误差,因此可以以更小的系统误差(例如原子缺失和放错位置)和较小的坐标平均误差来构建模型。坐标误差(大致定义为基于同一颗晶体的两次独立测量、模型构建和精修得到的模型之间的差异)与分辨率相关,但是与分辨率相比具有不同的数量级。它还受数据完整性(越高越好),free R因子(越低越好)和模型的完整性(越高越好)的影响。典型的基于2.0Å数据的晶体学模型的坐标误差小于0.2Å。一般要求R free不超过分辨率的10%。
衍射图样中的每个衍射点(也称为“反射”或“测量”)都有名义分辨率。每个衍射点的衍射角越高(即衍射图像越靠近外围的地方),其分辨率越高。在衍射实验中,目标是收集尽可能多的反射。然而,高分辨率的反射更难以测量,因为反射的强度在较高的衍射角处会变小。衍射数据集的总体分辨率是指所测反射的分辨率范围。例如,“从20.0Å到2.3Å收集的数据,整体完整性为96.5%”意味着收集了该范围内的大多数反射,并且该数据集将简称为“2.3Å分辨率”数据集。
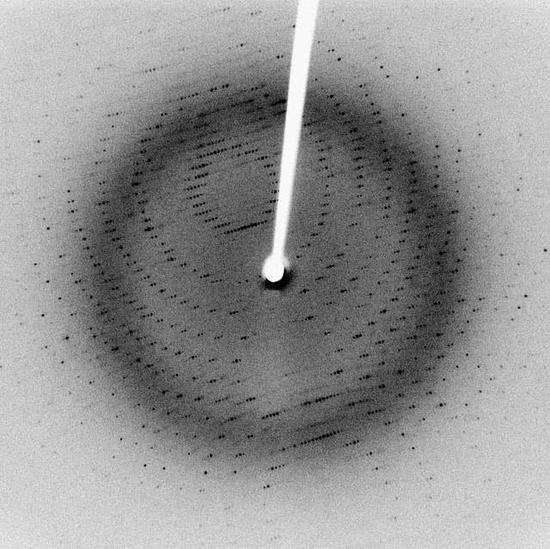
图3
总之,分辨率是衡量蛋白/核酸晶体数据质量的一种度量指标。如果晶体中的所有蛋白,那么衍射图将显示晶体的精细细节。相反地,如果晶体中的蛋白质全部略有不同,比如说由于局部柔韧性或运动性造成的不同,衍射图将不会包含太多精细信息。因此,分辨率是对衍射图样中存在的细节水平以及计算电子密度图时呈现的细节水平的一种度量。分辨率值为1Å左右的高分辨率结构是高度有序的,并且很容易看到电子密度图中的每个原子。 分辨率为3.5Å或更高的低分辨率结构可以显示蛋白质链及大侧链。 蛋白质的大多数晶体学定义的结构都介于这两个极端之间。
参考资料
http://proteopedia.org/wiki/index.php/Resolution
https://pdb101.rcsb.org/learn/guide-to-understanding-pdb-data/resolution
Souce: 纽普生物 2019-11-18