1. X射线晶体衍射解结构需要的软件:
1.1 原始数据处理:HKL3000、 MOSFLM 、 XDS等
1.2 解结构:CCP4, COOT, Phenix, CNS,ARP/wARP等
2. 冷冻电镜重构需要用到的软件:
2.1. 图片格式转化:IMOD;
2.2. 矫正卷积:Motioncorr;
2.3. 去未对焦偏移图片:CTFFFIND3
2.4. 选择范围,组装处理:RELION
2.5. 结构组装:UCSF Chimera
3. 蛋白结构预测用的在线工具:
推荐使用:I-TASSER (同源结构信息比较少)和Phyre2 (同源结构信息比较全)
4. 原核硒代蛋白制备方法:
硒代蛋白表达(Expression of SeMet-labeled proteins)
简介(INTRODUCTION)
如果某个蛋白没有同源结构,为了确定其相位,需要有重原子衍生物的蛋白晶体。目前最常用的手段就是引入硒代甲硫氨酸(SeMet)的方法。在蛋白表达过程中在培养基中加入硒代甲硫氨酸来替代通常的甲硫氨酸,因此表达出来的蛋白的甲硫氨酸全部取代为硒代甲硫氨酸。我们利用甲硫氨酸缺陷型菌株B834在无机的硒代培养基中表达目的蛋白。B834是一种改造过的表达菌株,缺失甲硫氨酸合成酶,因而不能自身合成甲硫氨酸,但是可以通过氨酰tRNA合成酶将外源的甲硫氨酸或者硒代甲硫氨酸加入到蛋白质的肽链中。
材料(MATERIALS)
o 试剂(REAGENTS)
B834,LB培养基,M9培养基,MediumA培养基,抗生素,硒代甲硫氨酸,IPTG
o 实验前准备(SETUP)
收菌瓶要提前高压灭菌,烘干,预冷。
o 器械(EQUIPMENT)
摇床,Thermo离心机
实验步骤(PROCEDURE)
1. 将重组质粒转化表达菌株B834(DE3)感受态细胞,涂板,37°C过夜培养。
2. 第二天,挑单克隆到5ml LB中,37°C摇过夜。
3. 第三天,将过夜菌全部加到1L LB中,在37°C摇床中摇到OD600达到1.0-1.5。
4. 将菌液3700g, 4度离心10min,弃上清,收菌瓶要提前灭菌,并放烘箱烘干,再放4°C预冷。
加入20ml MediumA培养基温和重悬菌液,此操作是为了洗去菌液表面残留的LB培养基,使细菌更快适应新的培养基,也避免丰富培养基中甲硫氨酸影响硒代效果。将菌液加入现配的等体积硒代培养基MediumA中(不含任何甲硫氨酸);在37°C摇床中摇4-8h至OD600=1.5
5. 加1ml 50mg/ml硒代甲硫氨酸,37°C生长30min。
6. 向菌液中加入IPTG诱导, IPTG终浓度为0.25mM,4 h @ 37°C or 20h @ 16°C。
7. 6000rpm, 4°C,10min收菌,弃上清。将菌体用样品匙取出,加少量裂解液润洗离心瓶后冻-80°C冰箱。
Medium A: 1000 ml 1× M9 medium
8ml 50% (w/v) glucose
1 ml 1 M MgSO4
0.3 ml 1 M CaCl2
1 ml 1 mg/ml Biotin
1 ml 1 mg/ml Thiamin
x ml antibiotics
1× M9 Medium: 17.1g Na2HPO4.12H20
3g KH2PO4
0.5g NaCl
1.0g NH4Cl
add ddH2O to 1L
1× M9 Medium, Glucose, MgSO4,CaCl2 需要高压灭菌;Biotin,Thiamin 和antibiotics需要用0.22um滤膜抽滤。
针对性建议(TROUBLESHOOTING)
硒代甲硫氨酸价格很贵,因此第一次做,先用甲硫氨酸结合M9培养基试一遍,纯化重组蛋白,计算得率和纯度,摸索所有步骤。然后再用硒代摇2-3L菌。硒代甲硫氨酸属于有毒物质,请带手套和口罩。
5. 天然提取的蛋白可以做结晶吗?
可以,跟重组表达的一样。但是因为没有tag, 纯化一般会比较难,如果能有办法纯化到95%以上会非常好。
6. 采用筛选机器人,单次筛选的蛋白质消耗量是多少?
筛晶体消耗的蛋白量取决于蛋白浓度,浓度需要做梯度,每1000个条件消耗的蛋白量在2.5mg-10mg之间,找到可能的结晶条件还要进一步优化。所以一般来说需要差不多20mg蛋白。
7. 结晶筛选的温度条件:
一般来说会尝试22度室温和4度低温
8. 如果蛋白不结晶有哪些解决办法
8.1 可以尝试突变掉带二硫键或者糖基化位点的氨基酸;
8.2 可以截取掉loop区或者把蛋白截短;
8.3 可以设计并加入底物类似物。
9. 蛋白-DNA复合物结晶的难点
需要尝试大量的不同长度的DNA片段,看哪个跟蛋白可以稳定结合。也同样可以用孵育的方法,孵育DNA-蛋白过夜以后跑分子筛,看看分子筛是不是单峰。
10. 蛋白性质-亲疏水,跨膜区,信号肽,二级结构分析预测的方法:
亲疏水分析:http://web.expasy.org/protscale/
跨膜区分析预测:http://www.cbs.dtu.dk/services/TMHMM/
信号肽预测:http://www.cbs.dtu.dk/services/SignalP/
二级结构预测:http://bioinf.cs.ucl.ac.uk/psipred
11. 厌氧蛋白在厌氧环境下的结晶可以做吗?
纽普生物目前不提供这样的结晶服务,需要与有全套厌氧环境实验室合作。
12. 蛋白纯度主要怎么判断:
主要通过SDS-PAGE胶图和分子筛来判断。
13. 蛋白溶解度太高,都60mg/ml了依然无法结晶怎么办
1. 可以根据有结晶迹象的条件,自己配结晶条件,增加沉淀剂的浓度;
2. 可以放在37度条件下结晶,加速蛋白析出。
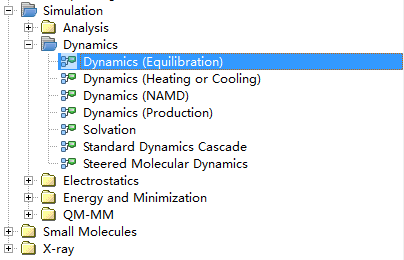
14. Discovery studio (DS) 分子动力学 (molecular dynamics) 有哪些可以运算:
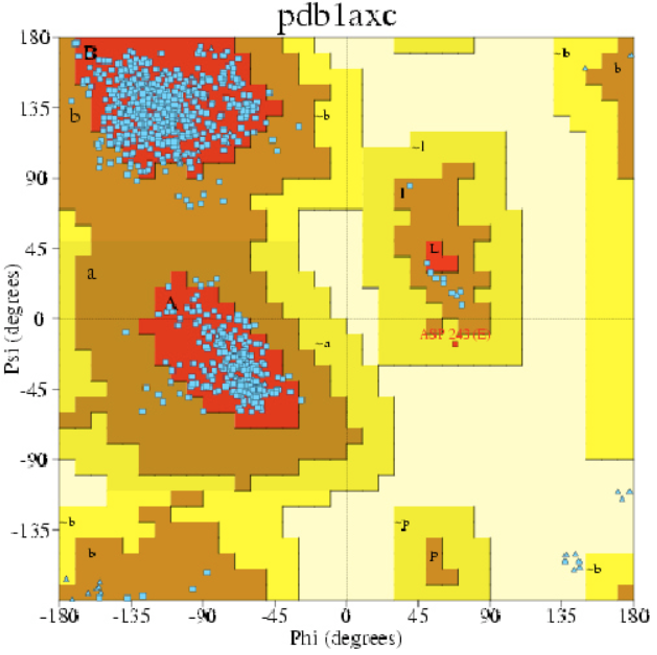
15. 结构解析以后,如何检查结构的数据质量(构象合理性)?
可以用procheck来检查。Prochek 通过Ramachandran plot(拉氏图),用来分析蛋白质结构中氨基酸残基二面角ψ和φ是否在合理区域。同时也可以反映出该蛋白质的构象是否合理。
16. Superdex200 分子筛上样要求?
体积不小于25ul,最好50ul。浓度尽量高,但是上样蛋白总量不超过10mg。

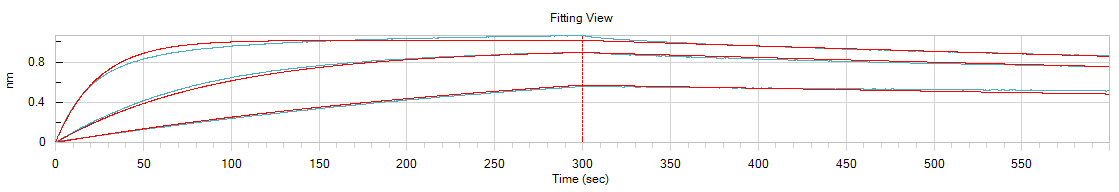
17. 亲和力实验好的数据应该是什么样的?
蛋白亲和力检测,亲和力较好的时候,应该满足亲和力平衡应该很快,解离很慢,如下图:
18. 得到的蛋白浓度很低 (0.1mg/mL) ,浓缩蛋白聚沉,怎么测定蛋白和小分子的亲和力?
有3个方法:1. 用ITC测;2. 换一个缓冲液(找到溶解度好的);3. 测DSF,对比加了小分子和不加小分子的数据。
Souce: 纽普生物 2020-01-09