IC50:半抑制浓度(或称半抑制率),即IC50,对指定的生物过程(或该过程中的某个组分比如酶、受体、细胞等)抑制一半时所需的药物或者抑制剂的浓度。药学中用于表征拮抗剂(antagonist)在体外实验(in vitro)中的拮抗能力。
pIC50:pIC50=-log(IC50)
EC50:是指在特定暴露时间后,能达到50%最大生物效应对应的药物、抗体或者毒素等的浓度。药学中除了用于表征体外实验中(in vitro)激动剂(agonist)的激活能力外,还可用于表示达到体内(in vivo)最大生物效应一半时所需的血药浓度。
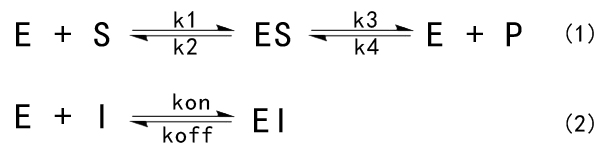
IC50不能直接等效于亲和力,但是两者还是有一定的数学关系的。对于酶促反应:
Ki=IC50/(1+[S]/Km), Ki是抑制剂的结合亲和力, IC50是抑制剂的功能强度;[S]为股定的底物浓度,Km为酶促反应速度达到最大反应速度一半时所对应的底物浓度(注意,它不是酶和底物的亲和力),是酶的特征常数。如果底物浓度远小于Km值,IC50等于Ki。
对于细胞受体的抑制常数:
Ki=IC50/(1+[A]/EC50),[A]是固定的受体激动剂浓度,IC50的值会随这不同实验条件而变化,如酶浓度,底物浓度等。Ki是个常数。
Ki:抑制常数(inhibition constant),反映的是抑制剂对靶标的抑制强度,这个值越小说明抑制能力越强,某些情况下可以与后文的Kd等同。Ki为50%的酶E被抑制剂I结合时对应的游离抑制剂的浓度。
IC50与实验中所用酶的浓度、底物浓度都有关,而Ki是不受这些变量的影响的。
Kd:解离常数(dissociation constant),反映的是化合物对靶标的亲和力大小,值越小亲和力越强。Kd=Koff/kon
Kd为50%的酶E被抑制剂I结合时对应的游离抑制剂的浓度。某些情况下,可与Ki等同。Kd一般通过SPR等实验测定,一般不存在底物;而Ki测定时,是同时存在底物的,有底物参与竞争。所以一般测定的Ki会比Kd要大。
Ka:结合常数(association constant),与Kd相反,值越大亲和力越强。Ka=1/Kd
Km:米氏常数(Michaelis-Menten constant),为酶本身的一种特征参数,其物理意义为当酶促反应达到最大反应速度一半时底物S的浓度。Km的大小只与酶的性质有关,而与酶的浓度无关,但是随着测定的底物不同、温度、离子强度和pH的不同而不同。当k2远远大于k3,Km近似等于ES的解离常数Kd。Km越小,意味着Kd越小,酶与底物的亲和力越高。
Kon:结合速率常数(association rate constant),代表分子间结合时的快慢,单位为M-1∙S-1。在Biacore测定亲和力实验中,Kon越大代表达到最大RU时间越短,曲线斜率越陡峭。
Koff:解离速率常数(dissociation rate constant),代表分子间解离时的快慢,单位为S-1。在Biacore测定亲和力实验中,Koff越大代表RU下降的速率越慢,曲线斜率越平缓。所以亲和力高的表现就是快结慢离。
KD:其实就是Kd,在SPR测定亲和力实验中,经常看到他们的手册中把Kon写成Ka, Koff写成Kd,把Kd写成KD。这样一来,KD=Kd/Ka。
Souce: 纽普生物 2020-01-11