在过去的几十年,科学家们一直在使用农杆菌介导的基因转化技术来培育转基因植物。最开始的时候,将感兴趣的基因(GOI)引入 T-DNA 的技术涉及复杂的微生物遗传方法,但 1983 年两个小组的突破性发现使得 T-DNA 和 vir 基因区域可以被分割到两个独立的复制子上,形成了 T-DNA 二元系统,该系统便于对农杆菌进行操作,促进了植物基因工程的发展。
提到T-DNA,就不得不提Ti 质粒和 Ri 质粒。Ti质粒存在于根癌农杆菌(Agrobacterium tumefaciens)中,Ri 质粒存在于发根农杆菌(Agrobacterium rhizogenis)中。Ti 质粒和 Ri 质粒在结构和功能上有许多相似之处,具有基本一致的特性。但实际工作中,绝大部分采用 Ti 质粒。下图是Ti质粒的基本结构。
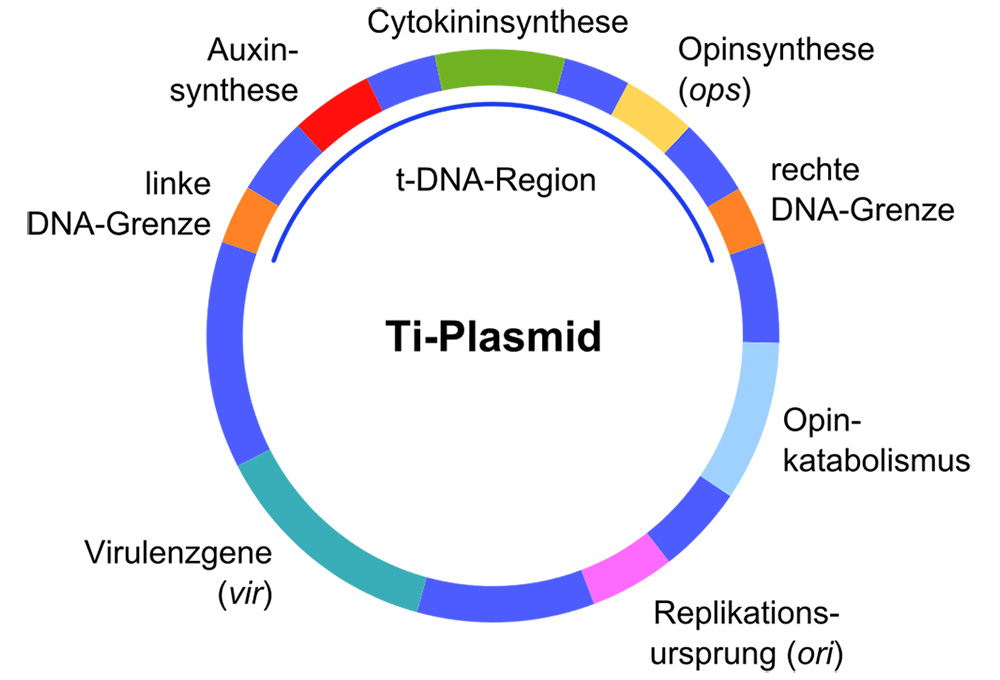
图1. Ti质粒的基本结构
Ti 质粒和 Ri 质粒是一种能实现 DNA 转移和整合的天然系统。Ti 质粒(Tumor induced Plasmid) 是根癌农杆菌染色体外的遗传物质,为双股共价闭合的环状DNA分子,长度约有150-200kb。Ti 质粒有两个重要区域:
① T-DNA 区(transfer DNA, 长度约为整个质粒的5%–10%):是质粒上能够转移整合入植物受体基因组并能在植物细胞中表达从而导致冠瘿瘤的发生,且可通过减数分裂传递给子代的区域。侵染植物时,从Ti 质粒上被切割单链,从而转移到植物细胞中。T-DNA由左右边界(LB/RB)界定,左右边界分别为25bP的重复序列, 其中14bP是核心, 是完全保守的。
② Vir 区:编码能够实现 T-DNA 转移的蛋白,使农杆菌表现出毒性,故也称作致毒区。Vir区段总长度大约35kb,由6个互补群组成,分别命名为VirA、VirB、 VirC、 VirD、 VirE和 VirG 。Vir区中各个基因之间都是相互联系相互影响的, 缺一不可。
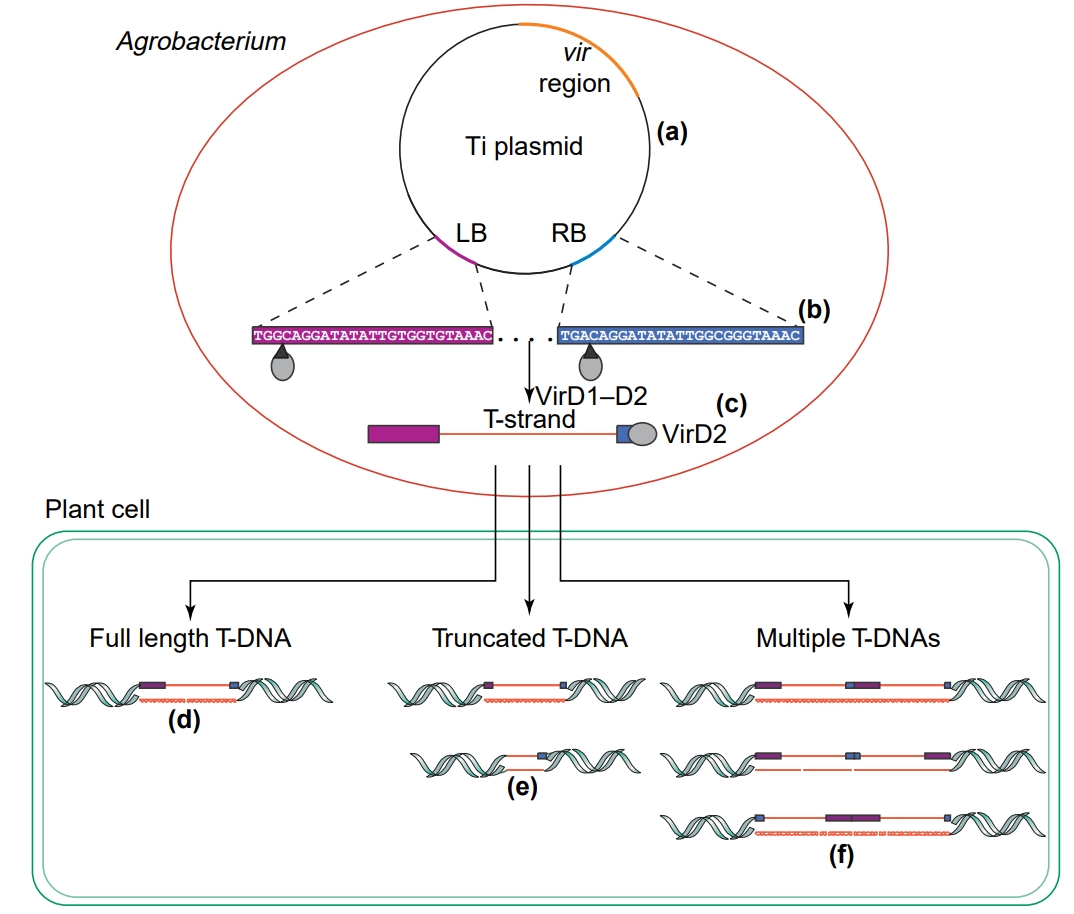
图2. 农杆菌Ti质粒转移T-DNA到植物细胞的大致过程
Vir区编码的VirD2–VirD1核酸内切酶复合物在左右边界的第三-第四碱基处产生缺刻,VirD2结合单链T-stand,转移到植物细胞中,并完成整合。
由于天然Ti 质粒载体的缺点明显:①分子量太大(200kb),基因工程中难以操作;②限制性酶切位点太多, 难以找到单一的限制性位点;③T-DNA区致瘤基因产物使被转化的植物细胞成为肿瘤, 阻碍细胞的分化和植株再生;④在大肠杆菌中不能复制;⑤质粒上存在一些对T-DNA转移不起作用的基因,因此人们开发了植物二元载体系统。
当Vir基因与T-DNA分别位于两个不同的质粒上时,即Vir区与T-DNA区分割开来以后,Vir基因仍然能够为T-DNA提供转移功能区的结构和功能,这就是这植物二元载体系统依据的原理。又因为其T-DNA与Vir基因在两个独立的质粒上,Vir基因通过反式激活T-DNA转移, 故称之为反式载体(trans vector)
T-DNA 边界重复序列
T-DNA由T-DNA 边界重复序列定义和界定,T-DNA 边界重复序列如下:
LB:tggcaggatatattgtggtgtaaac
RB:tgacaggatatattggcgggtaaac
值得注意的是,LB和RB都是有方向的,两者的方向相同,我们可以在LB和RB之间插入目的DNA(比如报告基因、蛋白编码区、启动子)等等,两个T-DNA边界重复序列中间的目的序列将整合到宿主基因组中。因此,T-DNA序列应该是tggcaggatatattgtggtgtaaac---GOI--- tgacaggatatattggcgggtaaac.
农杆菌将 T-DNA转移到多种植物中有三个必要元素:左右边界界定的重复序列T-DNA、vir 基因和细菌染色体上的某些基因。因此,实际在操作植物双元表达载体的时候,我们需要一个带Ti质粒的根瘤农杆菌,同时这个Ti质粒的T-DNA自身转移功能需要被破坏(比如GV3101、EHA105、AGL1、EHA101等根癌农杆菌);另外,我们还需要带有LB/RB DNA的穿梭质粒载体,这个载体能在农杆菌和大肠杆菌中复制。值得注意的是,使用多拷贝二元载体可能导致多个 T-DNA 拷贝整合到植物基因组中以及载体骨架序列整合到植物 DNA 中,从而加剧与植物转化相关的问题。从低拷贝数的 T-DNA 二元载体或农杆菌染色体启动 T-DNA 可能会缓解这些问题,提高农杆菌介导的转化事件的质量。因此,一般我们要求这个穿梭质粒在农杆菌中保持低拷贝。
oriV与pSa ori
我们在很多植物表达载体上可以看到pVS1 oriV、pVS1 RepA、pVS1 StaA元件,它们有什么作用呢?
首先,这三个元件都来自pVS1质粒,pVS1质粒是一种 30-kb 的非接合可移动质粒,从临床分离的铜绿假单胞菌 PAT 株系中分离出来,它可以借助接合质粒FP2进行接合转移。pVS1虽然不能在大肠杆菌中保持,但包括 pVS1 复制区(rep)和稳定区(sta)的质粒可以在许多假单胞菌、农杆菌和根瘤菌中进行稳定复制。
其次,pVS1 oriV是复制原点;pVS1 RepA对含pVS1的质粒进行低拷贝复制;pVS1 StaA,稳定蛋白,其功能是对pVS1质粒的稳定分离至关重要,确保子代都包含该质粒。
还有一些植物载体(比如pGreen、62-SK系列载体)上能看到pSa复制原点,这又是怎么一回事呢?
pSa复制原点来源于39-kb的IncW质粒pSa,分离自福氏志贺氏菌。pSa复制原点可以在多种革兰氏阴性菌中进行复制,包括大肠杆菌和农杆菌。pSa复制子全长1.7kb,由ori和RepA组成。pSa RepA 基因可在反式中作用于 ori,类似于 RK2 复制和复制起点元件的作用方式。
为了减少植物表达载体的尺寸、提高载体的灵活性和增强生物安全性,有研究人员把pSa RepA基因克隆到另外一个辅助质粒pSoup上从而开发了pGreen系列载体[1]。如果没有pSoup,这些质粒不能在农杆菌中进行复制。
还有些植物载体如pBI121系列载体、pBINPLUS系列载体上,会看到两个oriV,其中一个是来源于F质粒上的,另外一个来源于IncP。其中IncP来源的oriV配合trfA负责质粒在农杆菌中进行复制。
农杆菌除了能介导基因转移到植物,还可以转移基因到丝状真菌、甚至动物细胞[2]。
另外,一些植物载体上还能看到bom元件,它是basis of mobility region from pBR322,本质是一个oriT(接合转移的原点),在做三亲本杂交转化农杆菌时才用得上该元件,这种方法用的很少。
有些载体上还能看到NOS启动子和转录终止子,它们来源于根癌农杆菌Ti质粒,在Ti质粒上它编码的产物是D-nopaline dehydrogenase。
参考文献
1. Hellens RP, Edwards EA, Leyland NR, Bean S, Mullineaux PM. pGreen: a versatile and flexible binary Ti vector for Agrobacterium-mediated plant transformation. Plant Mol Biol. 2000 Apr;42(6):819-32. doi: 10.1023/a:1006496308160. PMID: 10890530.
2. Lee LY, Gelvin SB. T-DNA binary vectors and systems. Plant Physiol. 2008 Feb;146(2):325-32. doi: 10.1104/pp.107.113001. PMID: 18250230; PMCID: PMC2245830.
Souce: 纽普生物 2024-09-09