
剑桥大学医学院的吉利安·格里菲斯教授解释说过:“在我们每个人的体内都隐藏着一个连环杀手的大部队,它们的主要功能就是一次又一次地杀戮。”
格里菲斯教授口中所说的这支“部队”就是我们体内的T细胞,而CD8+ T就是这只部队中的王牌。CD8+T的杀手锏就是能够监视肿瘤,并且可以直接干掉肿瘤,就是这么的腻害!
但是,作为RMB玩家的CD8+T也不是能够随心所欲的实施暗杀的,因为在肿瘤微环境中,T细胞的作用会受到抑制,肿瘤细胞能够逃避免疫系统中T细胞的攻击。因此,T细胞和肿瘤两大阵营之间的斗争一直难分难解!
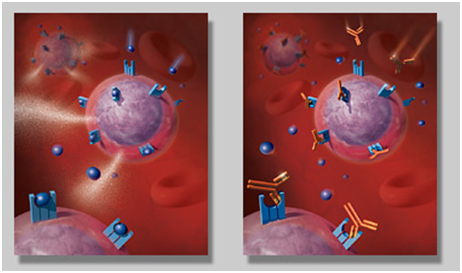
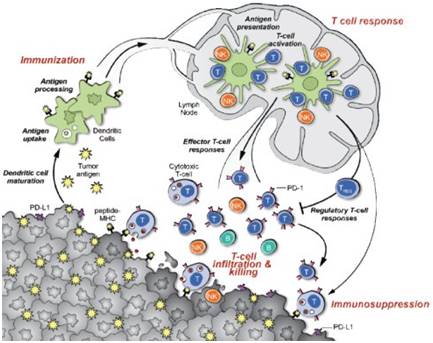
不过在最近,胶着的战局终于开始偏向T细胞了——中国科学院上海生命科学研究院生物化学与细胞生物学研究所的许琛琦团队和李伯良团队在小鼠中发现抑制胆固醇酯化能够增强CD8+T细胞的抑制癌细胞,在T细胞中通过基因敲除或者药物抑制来阻止胆固醇的酯化作用,将会导致CD8+T细胞的增殖增加,而不是CD4+T细胞,。
质膜胆固醇水平的提高会导致CD8+T受体的增多,同时形成有效的免疫突触。抑制胆固醇酯化酶ACAT1能够增加细胞质膜上的胆固醇水平,因而促进T细胞信号转导和杀伤过程。
也就是说,通过胆固醇的补给,T细胞中的CD8+T数量会大量增加,甚至会间接地提高CD8+T的杀伤力。
队伍壮大了,装备也得升级啊!于是开了挂的CD8+T又装备上了ACAT1的一种小分子抑制剂,叫作阿伐麦布(avasimibe),名字是有点绕口啊,但是这玩意可不能小觑。
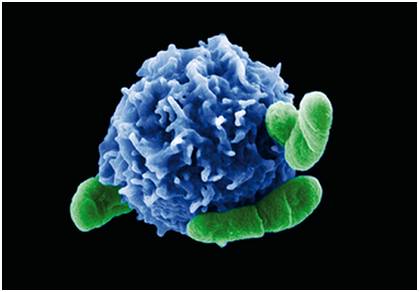
研究人员发现T细胞代谢通路中的胆固醇酯化酶ACAT1是一个很好的调控靶点,抑制ACAT1的活性可以大大提高CD8+T细胞(又名杀伤性T细胞)的抗肿瘤功能。因为ACAT1被抑制后,杀伤性T细胞膜上的游离胆固醇水平提高,从而让T细胞肿瘤抗原免疫应答变得更加高效。同时,研究人员还利用ACAT1的小分子抑制剂avasimibe在小鼠模型中治疗肿瘤,发现该抑制剂具有很好的抗肿瘤效应;并且avasimibe与现有的肿瘤免疫治疗临床药物anti-PD-1联用后效果更佳。
阿伐麦布(avasimibe)已被用来治疗动脉粥样硬化,并且安全性上非常好,后来在小鼠体内的研究发现可以抑制癌症,而且表现出良好的抗肿瘤效果。
因此,T细胞阵营先下一城,找到了对抗肿瘤的新的Buff:联合用药阿伐麦布和抗PD-1抗体表现出更好的抗肿瘤效果,ACAT1在动脉粥样硬化的临床实验中展现了良好的作用,而且在免疫治疗肿瘤中也将会是一种非常好的药物靶标。
2016-05-24