将感兴趣的目的细胞分离纯化出来,一直是细胞生物学中的一个重要研究手段。无论是体外刺激研究细胞因子的表达谱,还是细胞共培养检测细胞功能,均对细胞的纯度具有很高的要求。
目前分离纯化细胞的手段主要有两种:
MACS(magnetic-activated cell sorting),原理就是用结合了磁珠的抗体去标记细胞,让目的细胞带上磁珠,通过磁场将结合了磁珠与没结合磁珠的细胞分离开来。MACS是细胞分选的重要手段,设备简单,只需要一块磁铁,不需要专门的大型仪器,得到的细胞活性好,适合大多数的实验室。缺点就是能分选的细胞类型有限。
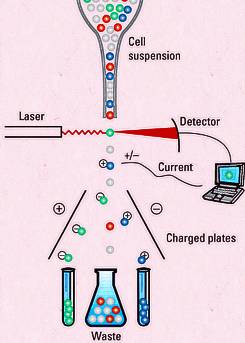
FACS(fluorescence-activated cell sorting),也就是我们今天要了解的流式分选。这部分原理与流式分析一致。利用荧光素标记不同的分子,通过调节合适的电压、补偿等,通过荧光将目的细胞与非目的细胞区分开来。
MACS和FACS的优缺点:

流式分选和流式分析在样本的准备上具有很多相通的地方,都是把样本处理成单细胞,最后上样的时候让细胞处于单个悬液的状态。绝大部分人不需要进行仪器的操作,更关心的是如何提高细胞得率以及如果提高分选出来的细胞活性等问题。
首先是样本的准备,无论是组织还是血液来源的细胞,均应保证细胞在上样之前处于比较好的状态。
提示:
-
可以在重悬细胞的时候PBS中加入1%-2%的胎牛血清
-
大部分流式分选仪的上样器均没有冷却系统,要想分选后获得比较好的细胞活性,应尽量减少细胞在室温的暴露时间
-
样本较多的时候可以分成小份体积上样,每次1ml或者2ml,剩下的放在冰箱冷藏。
该方法长时间分选的时候能较好地提高分选出来的细胞活性,缺点就是人不能长时间离开,以防止样品跑空,空气进入分选管道。
其次,我们来聊一聊分选的模式,一般的流式分选仪上都有三种模式:纯化(purify)、富集(enrich)、单细胞(single cell)。我们需要知道的是,流式分选是针对细胞所在的液滴进行操作,而不是针对细胞本身。
三种模式的异同点:
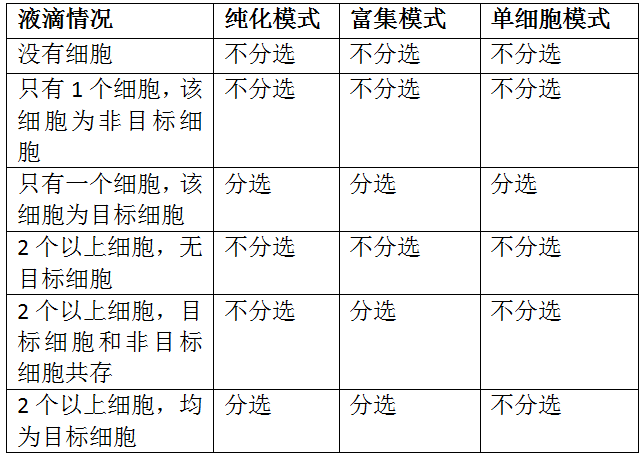
由上表我们可以看到,单细胞模式细胞得率最低,只有液滴中有一个且只有一个目标细胞才会被分选。纯化模式分选出来的都是目标细胞,纯度和单细胞模式分选一致。富集模式分选出来的纯度最低。
那么,如何提高分选效率?答案就是尽可能地使细胞分散成单个细胞状态。防止细胞粘连,同时细胞密度不宜过大,尽量使每个液滴中只含有一个细胞。在分选之前可将细胞用含EDTA的PBS清洗,去除钙离子,或者加入适度的DNA酶,去除死细胞DNA产生的粘连。EDTA可能会对检测造成一定的影响,具体细胞还得具体分析。
最后,细胞分选出来后我们需用离心管或者流式管收集,为了保证细胞的活性,收集管里需要放置一定的培养液,起到缓冲作用也可以给细胞提供一定营养。如果分选出来的细胞需要进行培养,还可在收集管中加入一定浓度的抗生素。如果分选环境不是特别干净,切记收集后要用含抗生素的PBS进行清洗,再用含抗生素的培养基进行培养,以防止细胞污染。
流式分选可用的很多,特别提出的一点是它除了可以进行四路分选以外,还可以分选单细胞,直接用96孔板进行收集,可以往每个孔里都只分选1个细胞。对于筛选细胞稳转株或者做单抗的同学来说可以大大缩短筛选细胞单克隆的时间。
来源:解螺旋
2016-05-27