肿瘤转移是肿瘤细胞从局部的侵袭,随着血行扩散,最终在远端靶器官生根发芽的多步骤过程。探索肿瘤转移机制,抑制其扩散到机体其他位置,也是我们基础和临床上的研究热点。有肿瘤科的小伙伴向麦子咨询如何研究肿瘤转移过程中的分子机制,其实对于刚起步的小伙伴,这无非也是一个模仿研究思路的过程,所以今天就以两篇文献为例进行讲解。
文献一
Co-expression of CXCL8 and HIF-1α is associated withmetastasis and poor prognosis in hepatocellular carcinoma. Oncotarget.(肝细胞癌中CXCL8和HIF-1α的高表达与肿瘤转移中肿瘤预后不佳相关)
研究思路总结
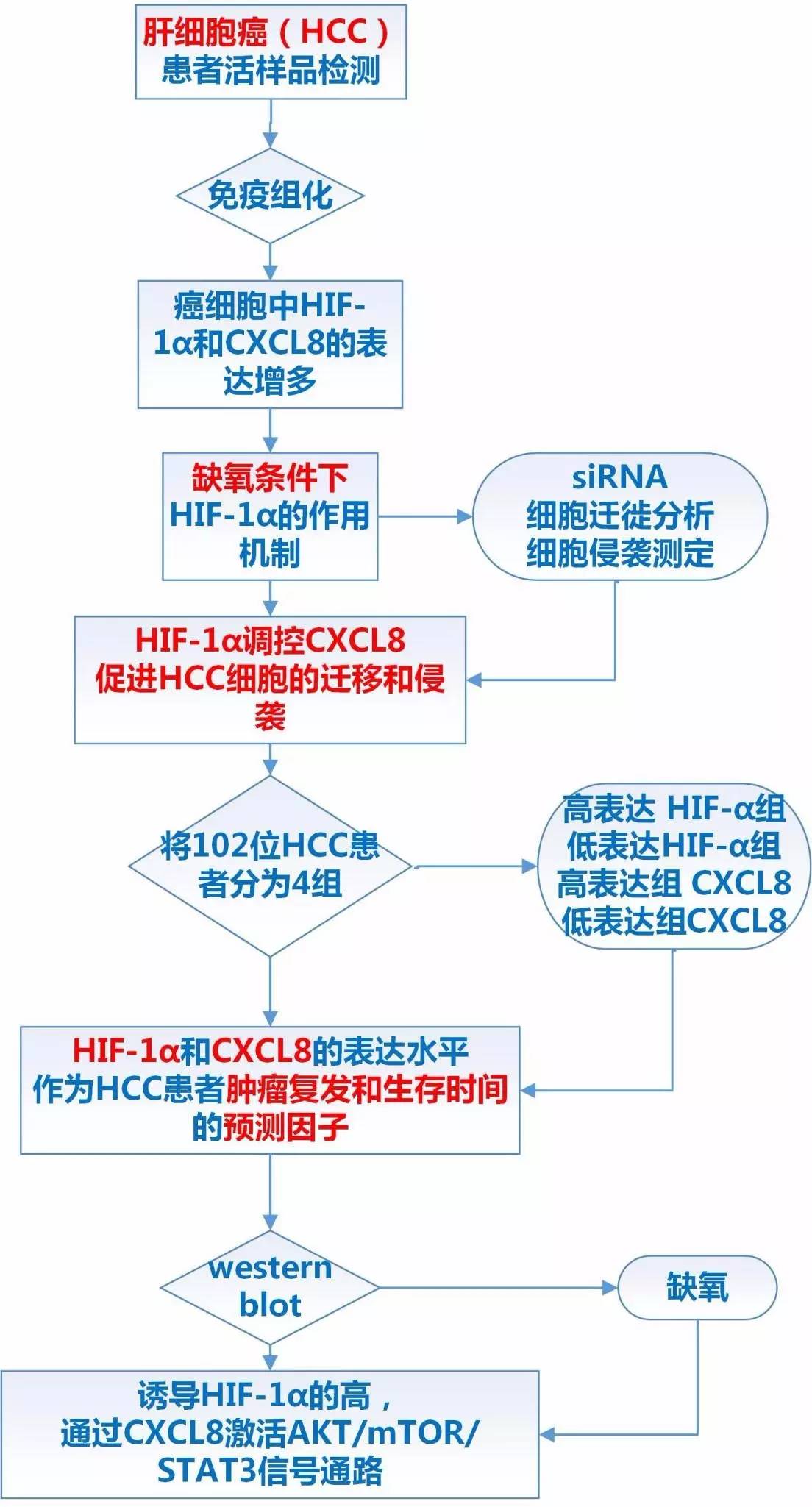
我们知道这个现象:肿瘤组织内部普遍存在缺氧的情况,缺氧通过缺氧诱导因子(HIF)促进肿瘤的转移和肿瘤血管生成。本文以此为基础,针对肝细胞癌转移过程中的分子机制进行了研究。作者通过分析活检样本中相关分子的改变,发现HCC患者肿瘤组织中的HIF-1α和CXCL8的表达水平与无病生存时间和总生存率相关,并探索了其中的机制。主要从以下五个方面展开:
1临床样本分析
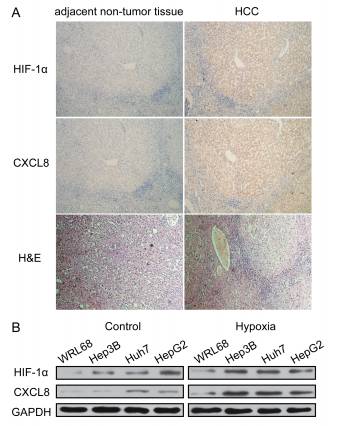
分析102位肝细胞癌(HCC)患者的活检样本,发现在肿瘤组织中存在HIF-1α和CXCL8 的高表达的情况。在缺氧条件下,所有HCC细胞株中HIF-1α和CXCL8的表达水平都有升高,而正常肝细胞细胞株的表达水平不变。
2细胞表型
缺氧能够明显增强Hep3B和Huh7细胞株的迁移和侵袭能力,而这个能力能够通过干扰CXCL8将其抑制。
3样本统计分析
肝细胞癌(HCC)活检样本中HIF-1α和CXCL8的表达量的不同与HCC患者的无病生存时间和总生存率相关。多变量分析得出影响总生存率和无病生存时间主要有4个相关性因子:HIF-1α和CXCL8的高表达,血管侵袭,肝内转移和远端转移。
4分子机制
缺氧诱导HIF-1α的高表达,通过CXCL8激活AKT/mTOR/STAT3信号通路,促进HCC细胞迁移和侵袭,从而促进肿瘤转移。
5临床意义
HCC患者肿瘤组织中的HIF-1α和CXCL8的表达水平可以作为肿瘤复发和生存时间的预测因子。本文通过多变量分析得出影响总生存率和无病生存时间主要有4个相关性因子:HIF-1α和CXCL8的高表达,血管侵袭,肝内转移和远端转移,为临床判断HCC的恶性程度,预测无病生存时间和总生存率提供了新的参考指标。
文献二
HER2 mediated de novo production ofTGF-βleads to SNAIL driven epithelial-to-mesenchymal transition and metastasis ofbreast cancer. Molecular Oncology.(HER2调控TGF-β的重新合成,通过SNAIL诱导细胞发生上皮-间质转化,即EMT过程,来促进乳腺癌转移)
>>>>
研究思路总结
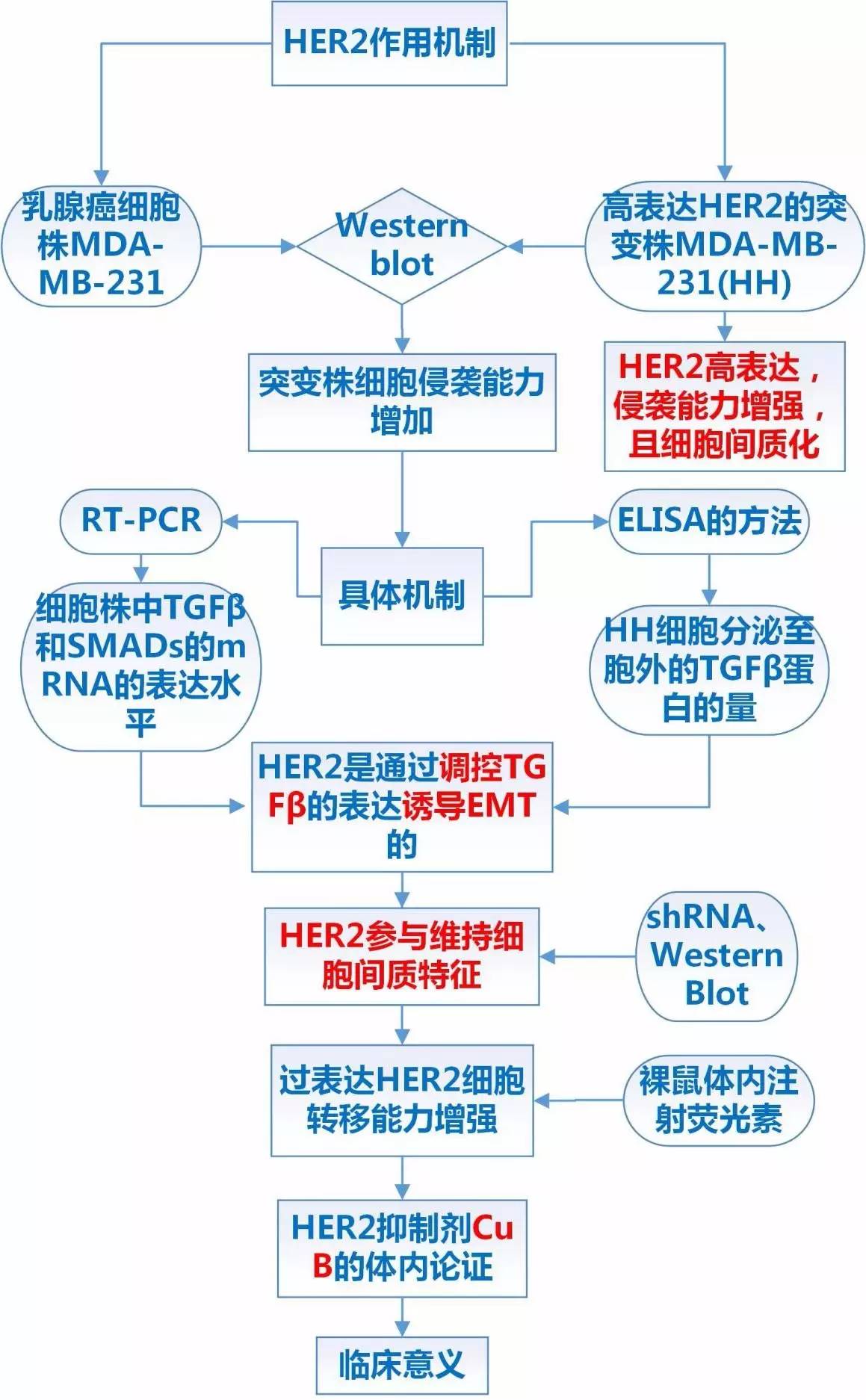
许多乳腺癌患者的肿瘤细胞中高表达HER2,过表达HER2的主要机制是基因扩增。肿瘤HER2高表达与肿瘤进展迅速,肿瘤耐药和预后不佳相关,肿瘤细胞发生EMT是肿瘤耐药的机制之一。本研究从体内和体外两个水平研究了过表达HER2在乳腺癌转移中发挥的作用,并且发现HER2抑制剂CuB能够在体内抑制肿瘤的转移。主要从以下三个方面展开:
1细胞表型
比较过表达HER2的乳腺癌细胞株(HH株)与亲本株细胞体外侵袭的能力,考察HER2相关信号通路和间质细胞标志分子的表达,发现过表达HER2促进细胞侵袭和间质向转化。
2分子机制
对比HH细胞株和亲本株HER2相关通路分子的表达,发现HER2的过表达,可引起核内SMADs的增加,通过增加SMAD4与SMAD2/3的结合促进TGFβ的表达,诱导细胞发生EMT。外源的TGFβ能够促进细胞间质化转变,干扰HER2细胞间质化程度降低,维持细胞的间质化需要HER2的参与。
3体内实验
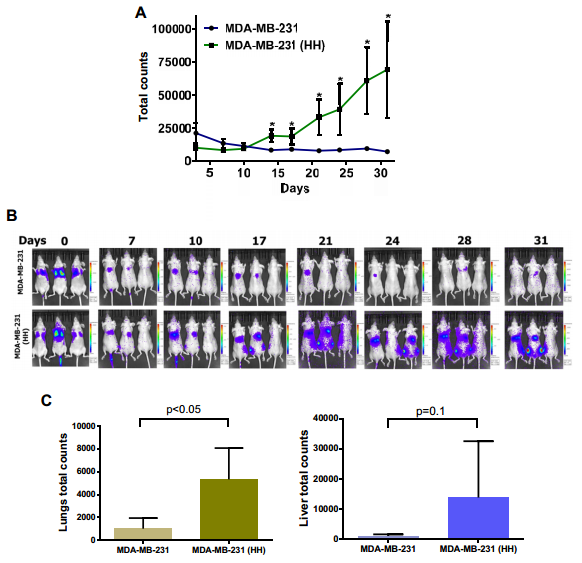
进行裸鼠体内转移模型实验,对比HH细胞与亲本细胞体内转移的能力,发现HER2的过表达能够在体内促进肿瘤转移。另外,HER2抑制剂CuB能够在体内外两个水平上抑制肿瘤的转移。
综上,本研究主要发现在乳腺癌细胞中HER2的过表达能促进乳腺癌细胞的侵袭和间质向转化:HER2调控TGFβ的重新合成,通过SNAIL诱导细胞发生上皮-间质转化(EMT),促进乳腺癌转移。使用CuB阻断HER2能够在体内和体外抑制TGFβ通路,降低乳腺癌细胞的侵袭和迁移能力,抑制乳腺癌的转移。
从上面两篇文献大家可以看出,肿瘤转移的研究都是从临床现象和临床样本为出发点,通过分子生物学的实验手段验证异常表达的分子的作用,并找出异常表达所影响的分子通路,最终回归临床意义的过程。
来源:解螺旋
2016-06-03