1. 少突胶质前体细胞(OPCs)
少突胶质细胞,可构成神经元细胞轴突表面髓鞘,负责跳跃性神经传导以及维持轴突的完整性。其前体细胞,少突胶质前体细胞(OPCs),产生于胚胎脊髓脑室区。较之于神经元细胞以及其它神经胶质细胞,OPCs具有更强的迁移能力。
具体表现在两点,1.他识路。2.他能够突破层层紧密发育的组织,直至目的地!
美国加州大学旧金山分校(UCSF)的StephenFancy教授和他的团队的一项最新研究表明,OPCs可通过在血管上攀爬和摆动,迁移到发育的大脑中。该项结果发表在顶级期刊《Science》上。

2.血管好像他的攀爬架
迁移中的OPCs,表达血小板生长因子受体α(PDGFRα),起始于内侧神经节隆起和血管相连的部分。在荧光显微镜下研究人员发现,很多迁移的OPCs紧贴着血管组织。据分析,58%的OPCs直接贴在血管内皮细胞表面。

研究人员观察到,OPCs的运动方式有两种。一是依附在血管上“匍匐前进”;除此之外,高能的是他能够“跳跃”,从一根血管,转移到另一根血管(Ps.再没有见过这么执着的细胞迁移了。。。)。
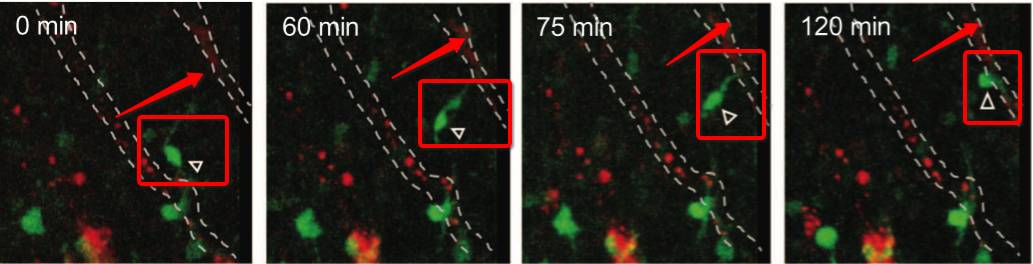
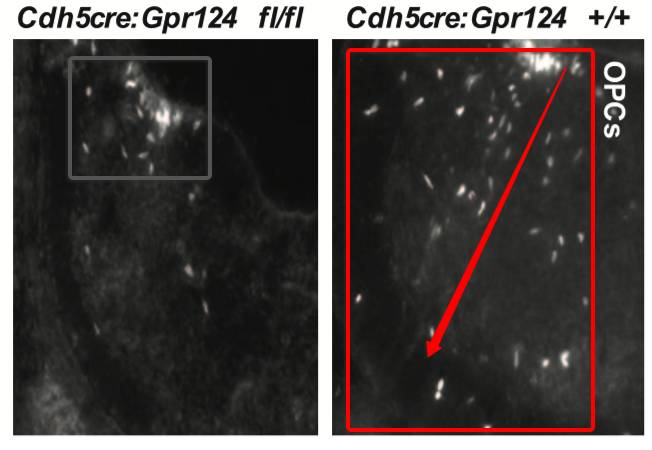
研究人员敲出GPR124基因,敲除这种基因后,小鼠中枢神经血管发育异常。研究发现GPR124敲除小鼠,OPCs很反常的在脊髓运动神经元前体区域(pMN),不能正常的迁移。可见,OPCs的迁移作用,离不开血管组织。

再进一步研究,敲除Cdh5cre导致血管内皮细胞功能异常,OPCs也失去了迁移的能力。
3.意外发现——Wnt
以前的研究表明,Wnt信号通路可抑制OPCs的分化。然而,Fancy研究团队注意到,当他们保持小鼠高水平的Wnt信号时,OPCs迁移出现了异常,似乎粘在了血管上。
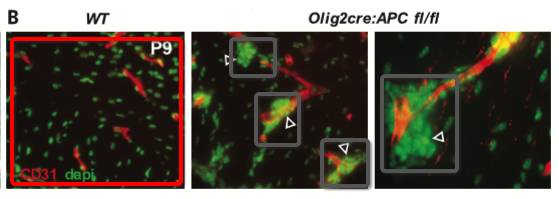
研究人员使用了Olig2-cre:Apc(fl/fl)小鼠,这种小鼠缺少Wnt负调控因子APC,OPCs中Wnt信号高度激活。APC条件敲除小鼠中,OPCs不能有效的从血管上脱落。
实际上,胚胎期OPCs能够大量分泌Wnt配体,自分泌或旁分泌激活Wnt信号通路,保证了早期OPCs的迁移能力。
为了进一步研究Wnt信号通路对OPSc粘附能力的影响。研究人员构建了条件高水平上调Wnt信号通路的工具鼠,上调CXCR4信号通路。CXCR4被证明和OPCs迁移有关。研究人员证明了,OPCs的血管粘附能力是CXCR介导的Wnt激活作用
(PS.机制部分研究有点水)。
综上所诉,我们得出了这个猜想:OPCs沿着血管迁移时,Wnt信号通路高度激活维持着OPCs血管粘附能力;当它们到达目的地时,Wnt信号通路关闭,OPCs从攀爬架脱落,进而增殖、分化。
多发性硬化症(MS)这种中枢神经最常见的退髓鞘病变,近年来科学家对其进行了大量研究,并取得了很大进展。2014年5月,在Cell期刊旗下《Stem Cell Reports》杂志发表的一项研究中,因为MS而严重残疾的小鼠,在经过人类神经干细胞治疗后不到两个星期,就恢复了行走能力。此后的7月份,美国纽约干细胞基金会研究所的科学家,首次产生了来自于原发性进展型多发性硬化症患者皮肤样本的诱导多能干细胞(iPS),他们开发了一种加速程序,诱导这些干细胞转化成少突胶质细胞——中枢神经系统的髓鞘形成细胞,参与多发性硬化症和其他疾病。
本研究人员指出:“目前,有一些药物能帮助减少多发性硬化症最初的髓鞘脱失,但还没有治疗方法可帮助髓鞘再生。通过获得关于大脑发育的研究结果,我们也将坚持去了解更多关于疾病的情况。”
(我们也是。)
2016-06-03