CRISPR/Cas系统是在大多数细菌(40%)和古细菌(90%)中发现的一种天然免疫系统,可用来对抗入侵的病毒及外源DNA。CRISPR指的是规律成簇的间隔短回文重复(Clustered regularly interspaced short palindromic repeats)。 Cas(CRISPR-associated genes)为CRISPR相关基因。
当噬菌体感染细菌后,病毒DNA进入细菌细胞内,细菌细胞表达Cas复合体对噬菌体DNA进行切割得到间隔序列(spacer),间隔序列在cas1 和cas2作用下插入到CRISPR序列前导区下游,完成外源DNA的捕获(如图1),形成免疫记忆。
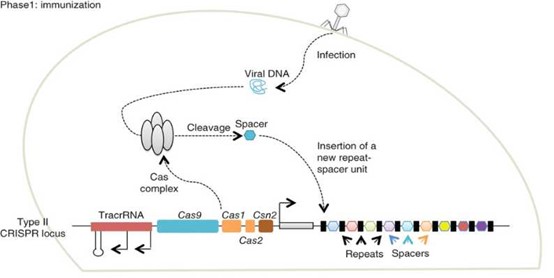
图1. 细菌对噬菌体免疫-Phase 1
当噬菌体再次感染细菌时,以较为简单的Type II型CRISPR/Cas系统为例,细菌表达 tracrRNA、前体crRNA及Cas9蛋白(RNA引导的核酸内切酶),tracrRNA和crRNA由于部分序列互补而结合,Cas9与tracrRNA和crRNA形成复合体并由Cas9加工成为成熟crRNA-tracrRNA Cas9复合体,成熟复合体由间隔序列引导识别病毒靶序列,并切断病毒DNA(如图2)。复合体只能识别与间隔序列一致并且3'端含PAM(protospacer adjacent motif,原间隔序列邻近模块序列)的靶序列,这是CRISPR/Cas9不剪切自身间隔序列的原因。不同来源CRISPR/Cas9系统有不同PAM序列,如链球菌CRISPR/Cas9系统PAM序列为NGG。
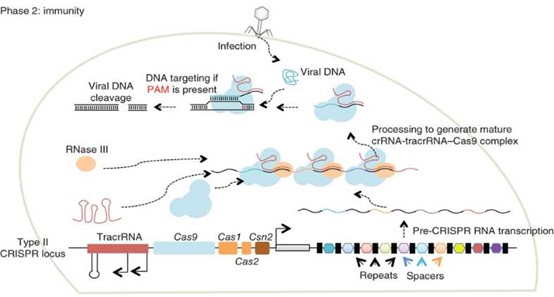
图2. 细菌对噬菌体免疫-Phase 2
CRISPR/Cas可分为二大类群:Class 1以多个Cas组成的效应复合体行使功能为特征,包括Ⅰ、Ⅲ和Ⅳ型;Class 2则只需单个多结构域的Cas,包括Ⅱ(Cas9)、Ⅴ(Cas12)和Ⅵ(Cas13)型(表1)。Class 2系统简单、高效、操作方便,是目前主要的基因编辑系统,其中最具代表性的是Cas9。
本文主要讲解Cas9。
如图3所示,CRISPR-Cas9系统由三部分组成,crRNA(读作CRISPR RNA)、tracrRNA(读作tracer RNA)和Cas(CRISPR-associated)核酸酶。crRNA和tracrRNA一起组成gRNA(guide RNA,向导RNA)。图3左边是自然界gRNA的结构,右边是人为制造的gRNA,将crRNA和tracrRNA融合为一条链(又称为sgRNA)。
gRNA 骨架部分与Cas核酸酶相对应。不同的Cas核酸酶结合不同的gRNA 骨架。
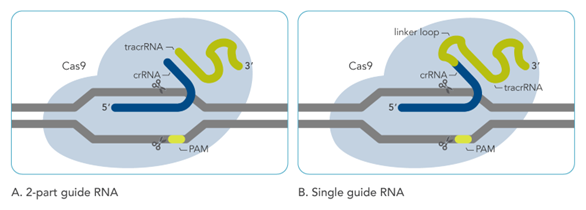
图3 CRISPR-Cas9系统
下图以更加具体的例子来说明CRISPR-Cas9系统。
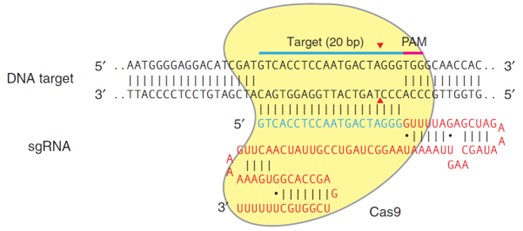
图4. CRISPR-Cas9 system
Cas9蛋白结合sgRNA通过20nt长的向导RNA(蓝色)与人EMX1基因DNA结合;红色部分是sgRNA的骨架;粉色标记的是PAM序列,此处为TGG;Cas9会在PAM序列的上游约3bp出会产生一个双链断裂(DSB),图中红色箭头指示DSB断裂处。
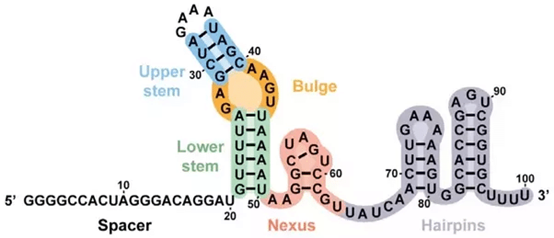
图5 spCas9 的gRNA
如果要亲手设计gRNA,那还是又必要详细了解下Cas9 gRNA的结构。如上图所示,这是一个spCas9 的gRNA,其中1-32位是crRNA;37-100位是tracrRNA。Briner et al.在crRNA和tracrRNA之间加上了GAAA linker,使得这两个RNA形成单一一条RNA。这样做的目的是简化CRISPR系统,这样就可以不用表达三样东西,如Cas9,tracrRNA和crRNA,而只用表达Cas9和sgRNA这两样。从效率上来说,会提高不少。我们通常说的gRNA设计,其实设计的是1-20位,也就是Spacer部分,其余的部分是固定的,称为sgRNA scaffold。不同种属来源的Cas9的sgRNA scaffold序列不一样。
SpCas9(常用的有两个版本)
Chen(2013):
GTTTAAGAGCTATGCTGGAAACAGCATAGCAAGTTTAAATAAGGCTAGTCCGTTATCAACTTGAAAAAGTGGCACCGAGTCGGTGCTTTTTTT
Hsu (2013):
GTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGCTAGTCCGTTATCAACTTGAAAAAGTGGCACCGAGTCGGTGCTTTTTT
SaCas9
GTTTTAGTACTCTGGAAACAGAATCTACTAAAACAAGGCAAAATGCCGTGTTTATCTCGTCAACTTGTTGGCGAGATTTTTT
FrCas9
GTTTGAGTGTCTTGTTAAGAAATTAACAAGATGAGTTCAAATCAGGCTCCTAGAGAGATCCGAACTTACCTTCATGGCGGGCATTGTGCCCTTTTTT
由于Cas9会在PAM序列的上游约3bp出会产生一个双链断裂(DSB),细胞主要启动两种“DNA修复”细胞信号转导通路:同源重组修复(HDR)与非同源末端连接(NHEJ)。
HDR需要我们额外提供同源模板,如果没有同源模板,NHEJ通路发挥功能,断裂的两条DNA直接连接,同时会产生几个碱基的插入或者删除,只要插入/删除的碱基数不是3的倍数(概率为三分之二),同时DSB在蛋白的编码区,那就有可能产生移码,使得蛋白失去功能,从而达到knockout(ko)的目的。所以,为了实现CRISPR ko,Spacer应该尽量避免设计在太靠近氨基端(下游的ATG可能起始翻译)或者太靠近羧基端的位置,更稳当的做法是设计几条gRNA,产生好几个DSB。
如果想通过HDR进行基因编辑,比如引入荧光标签,靶位点的选择很大程度上受到编辑所需位置的限制;当切割位点距离修复模板的近端> 30nt时,效率急剧下降(Yang et al , 2013)。
如果我们让Cas9失去切割双链DNA的能力,也就是不引起DSB,但仍能在gRNA的引导下,特异性地结合到目标DNA序列上,就可以实现CRISPRa (激活)和CRISPRi (抑制)技术,可以在转录水平调控基因表达。首先,我们需要一个dCas9蛋白(没有切割活性的Cas9),它是在野生型Cas9的两个关键核酸酶活性位点(RuvC和HNH)引入突变(如D10A和H840A)后得到的。当dCas9被引导到靶基因的转录起始位点TSS(transcription start site)时,dCas9能够物理性阻碍RNA聚合酶的通过,导致基因沉默。同时dCas9融合了一个基因抑制结构域,如KRAB结构域,这样的蛋白称之为dCas9-KRAB,可以进一步提高转录抑制的效率。此外,dCas9也可以融合双抑制结构域KRAB-MeCP2,抑制效果更佳。
当dCas9连上转录激活子(如VP64、p65和HSF1),通过gRNA引导dCas9到目标基因的启动子或增强子区域,来激活基因的转录。这些激活因子通过吸引转录机器(如RNA聚合酶和其他转录因子)增加目标基因的转录水平。
对于CRISPRa,靶向转录起始位点(TSS)上游~100nt的窗口是最有效的,而对于CRISPRi,位于TSS下游~100nt的窗口,具有最高的活性。因此要设计CRISPRa或者CRISPRi的gRNA,需要知道转录起始位点信息。
gRNA的脱靶活性是需要重点考虑的。研究表明引导序列 3'端的 8-14 个碱基对错配的容忍度低于 5'端的碱基;一般来说,超过三个错配是不能容忍的;一些引导序列对错配的容忍度低于其他引导序列;脱靶切割对转染量以及 Cas9 和 sgRNA 的相对比例高度敏感。
了解完设计的基本原则后,就可以借助在线工具进行gRNA设计了,比如CRISPick。
表1. Class 2 CRISPR system
| CRISPR系统 | 类型 | 分类 | 核酸酶结构域 | PAM/PFS | 向导RNA | 是否需要tracrRNA | 向导RNA长度 | 靶向 | 反式切割 |
| Cas9 | Class 2 | Type II-A | HNH and RuvC | NGG | sgRNA | 是 | ~100 nt | dsDNA | 无 |
| Cas12a (Cpf1) | Class 2 | Type V-A | RuvC | (T)TTN | crRNA | 否 | 40-44 nt | ds/ssDNA | ssDNA |
| Cas12b | Class 2 | Type V-B | RuvC | TTTN | crRNA | 是 | 40-44 nt | ds/ssDNA | ssDNA |
| Cas13a (C2c2) | Class 2 | Type VI-A | 2 x HEPN | non-G | crRNA | 否 | 64-66 nt | ssRNA | ssRNA |
| Cas13b(C2c4) | Class 2 | Type VI-B | 2 x HEPN | non-C or NANF/NNA | crRNA | 否 | 58-66 nt | ssRNA | ssRNA |
| Cas14a (Cas12f1) | Class 2 | Type V-F1 | RuvC | 无 | crRNA | 是 | ~140 nt | ssDNA | ssDNA |
请注意,表格中的"dsDNA"代表双链DNA,"ssDNA"代表单链DNA,"ssRNA"代表单链RNA,"PAM"代表原间隔序列(protospacer-adjacent motif),"PFS"代表前间隔序列侧翼位点(protospacer flanking sequence)。"反式剪切"(trans-cleavage)指的是CRISPR-Cas系统在切割目标DNA或RNA后,是否还能进一步切割其他非目标序列。CRISPR-Cas切割目标DNA或者RNA称为顺式剪切(cis-cleavage)
Souce: 纽普生物 2024-08-13