化学遗传学是指通过对生物大分子实行改造,使其能和先前无法识别的小分子进行相互作用,从而达到可控和可逆地(伴随加入或除去化合物而启动或中断特定的反应)控制生物大分子的活性,进而特异性地影响生理活动。
化学遗传学技术已经在信号转导、药物开发、功能基因组学等方面的研究中得到了广泛的应用。只由特定药物激活的受体(Designer receptors exclusively activated by designer drugs,DREADDs)技术是目前应用最广泛的化学遗传学技术,2007年由Armbruster和Roth等人发明,他们改变了G蛋白偶联受体——蕈毒碱型乙酰胆碱受体(muscarinic acetylcholine receptor, mAChR)的结构,改变后其只能被特定的化合物Clozapine-N-oxide(CNO,氯氮平N-氧化物)激活或者抑制。此类改变的受体会选择性地作用于不同的GPCR级联反应,其中应用最广泛的是Gq-DREADD和Gi-DREADD,被广泛用于以细胞特异性、无创地增强或抑制神经元的活动。
在正常生理条件下,人毒蕈碱型乙酰胆碱受体亚型M3(hM3)能与内源性神经递质乙酰胆碱(Ach)结合,然后与Gq类的G蛋白偶联受体耦合,参与Gq类信号通路。人毒蕈碱型乙酰胆碱受体亚型M4(hM4)能与乙酰胆碱(Ach)结合,继而与Gi类的G蛋白偶联受体耦合发挥作用,参与Gi类信号通路。然而,当将hM3与hM4上的两个保守位点突变后(分别为Y149C和A239G、Y113C和A203G),两者均不再与乙酰胆碱结合,而是能与外源的CNO高效结合。我们把突变之后的两种受体分别称之为hM3Dq和hM4Di。在CNO的刺激下,hM3Dq起到激发神经元的作用,hM4Di则能导致神经元细胞动作电位发放的抑制。
补充点细胞生物学基础知识:GPCR发挥的生理功能在很大程度上由其所激活的细胞内效应蛋白(G蛋白等)决定。G蛋白是异源三聚体蛋白,由Gα、β 和 γ 亚基组成。配体结合的 GPCR 会诱导 Gα 亚基发生构象变化,从而导致鸟嘌呤核苷酸交换(GDP 释放和 GTP 结合)以及 Gα 亚基从 Gβγ 复合物中解离。Gα 亚基是已知的 GPCR 信号转导的主要决定因素。根据下游信号转导和序列相似性,人类基因组中编码的 16 个 Gα 亚基被分为四个亚类: Gs、Gi、Gq 和 G12。每个亚类都会引起独特的反应,如 cAMP 增加(Gs)、cAMP 减少(Gi)、Ca2+ 和 IP3 增加(Gq)以及 Rho GTPase 激活(G12)。上文提到的hM3和hM4都是GPCR,它们参与的信号通路不一样。
腺相关病毒(AAV)作为一种安全、持久、高效、高特异性的基因操作工具,在生物学特别是神经生物学领域中被广泛使用,AAV是基因治疗最重要的一种基因递送载体。为了特异的调控基因在神经细胞中的表达,可以采用:原位注射、特定血清型、特异性的启动子以及Cre-loxP系统方法,这些方法可以单独使用,也可以联合使用。比如同时采用原位注射+特定血清型+特异性启动子,三重保证体内基因的特异性调控。
AAV1, AAV2, AAV4, AAV5, AAV8, AAV9血清型的AAV可以靶向中枢神经系统(CNS);hSyn启动子可以特异地在成熟神经元中启动转录、CaMKIIα特异地表达在兴奋性神经元(即谷氨酸能神经元)中、GFAP启动子在星形胶质细胞特异性表达、CD68在小胶质细胞特异性表达;对于Cre-loxP系统,我们可以采用条件性基因激活表达策略,目的基因刚开始时为默认不表达,但是在Cre重组酶共表达的情况下将被激活表达,并且将反转和改变目的基因的编码方向。Cre存在的情况下,目的基因的表达受用户自定义的启动子的调控。Cre-loxP系统我们重点讲讲。
依赖于Cre酶的基因开启方式
依赖于Cre酶的基因开启方式常见的有两种:lox-STOP-lox和DIO/FLEX开关(如下图1和图2)。
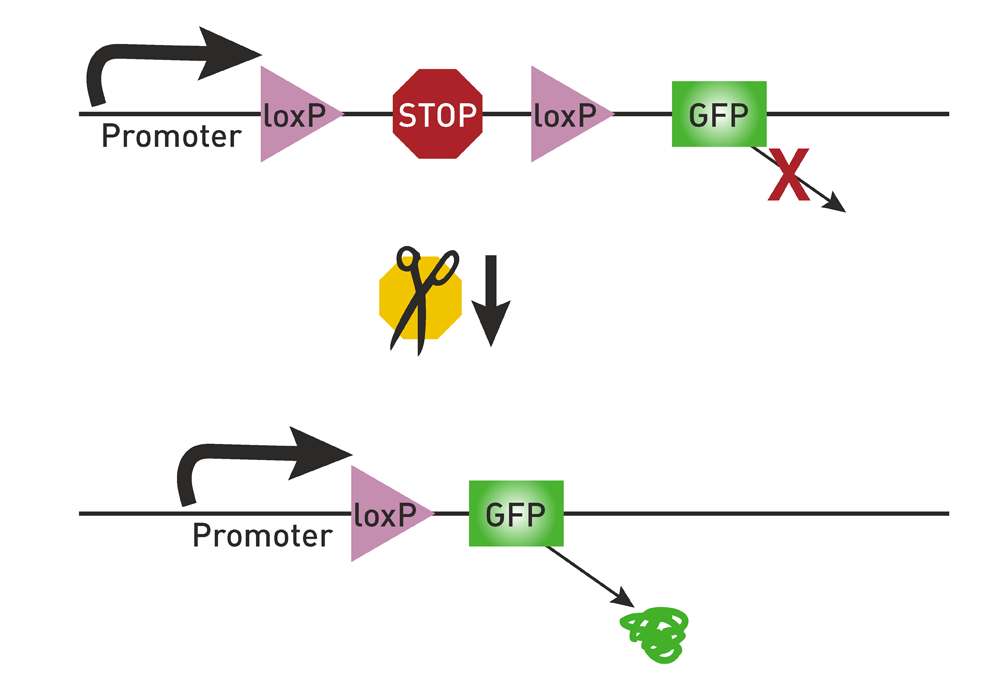
图1 lox-STOP-lox
在目标基因(如下图中的绿色荧光蛋白GFP)之前,构建一段包含两个同向的Loxp的基因序列,两个Loxp之间是一个阻止基因转录的STOP序列。由于STOP序列的存在,绿色荧光蛋白是无法被转录翻译的。当Cre酶出现时,Cre酶会切除同向Loxp之间的STOP序列。之后,绿色荧光蛋白便会顺利表达。这一过程是可逆的。lox-STOP-lox策略的缺点是有泄露表达。
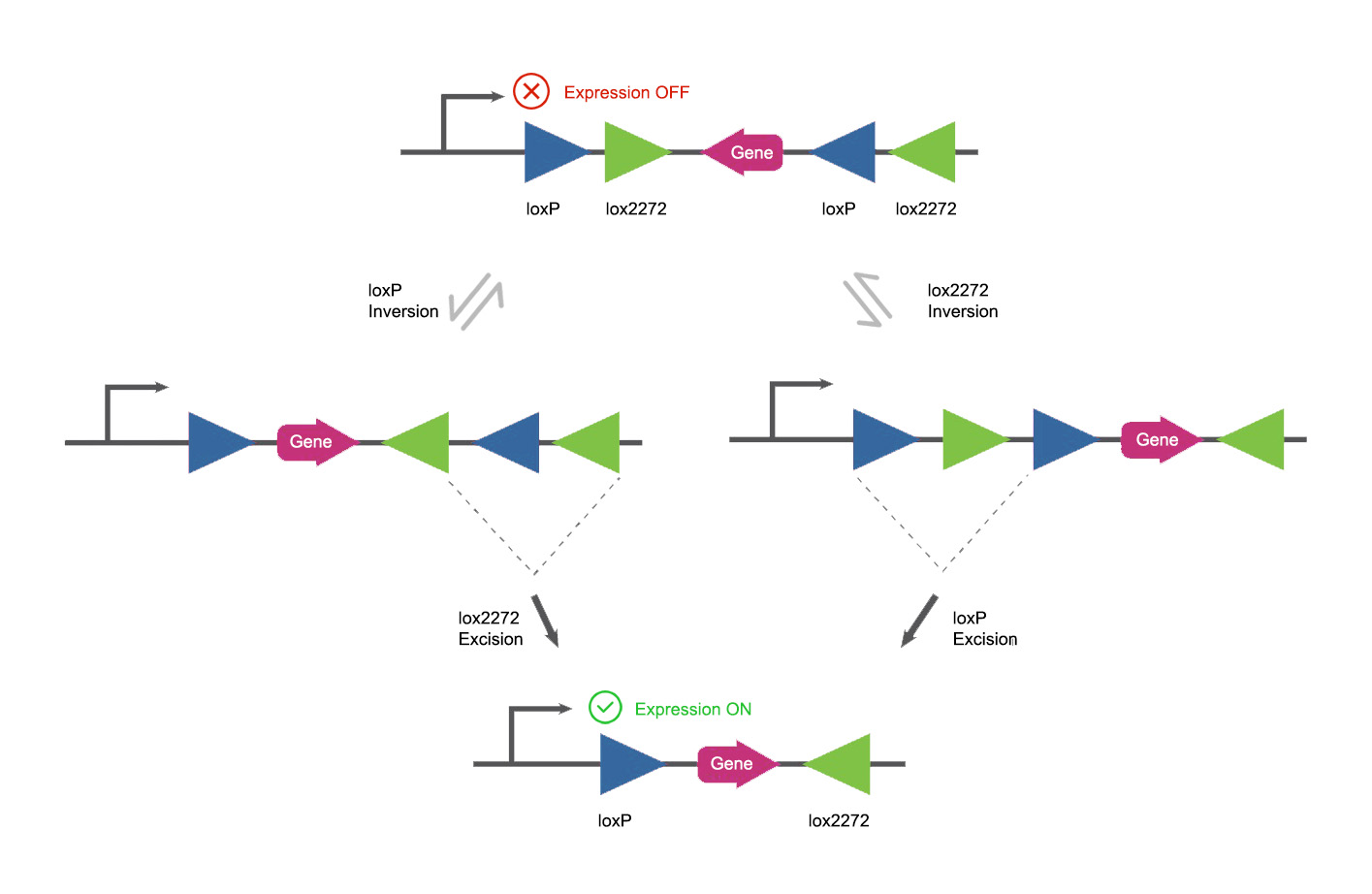
图2. DIO/FLEX
两种loxp之间的序列是目标基因,目标基因的序列是反向的,无法表达出有意义的蛋白质。当Cre酶出现时,Cre酶的连续重组作用最终会将反向目标基因变为正向,之后目标基因便可正常表达。
Cre酶的重组过程分为两步。
第一步是反转。在Cre酶作用下,两个方向相反的LoxP之间的序列,会被反转。反转可能发生在两个LoxP之间,也可能发生在两个Lox2722之间。这两个反转无论谁发生,都不会影响最后结果。这一步的重组反应是可逆回去的。
反转发生后,下一步是Cre酶引发的重组删除。LoxP引发的反转会让两个原本反向的Lox2722变为同向,反之亦然。同向的两个LoxP或Lox2722位点会引发Cre酶的剪切功能。Cre酶会剪切掉一个Lox2722和一个LoxP。最后剩下的一个LoxP和Lox2722之间不会再发生Cre酶的重组,也不会再逆反回去。它是稳定的状态。
Cre重组酶的导入方式可以是AAV导入、或者用Cre工具鼠;其中Cre工具鼠主要分为 3 类:全身性 Cre、组织特异性 Cre 和配体或药物诱导 Cre。
我们接下来以一篇论文[1]作为案例把上述内容整合到一起。
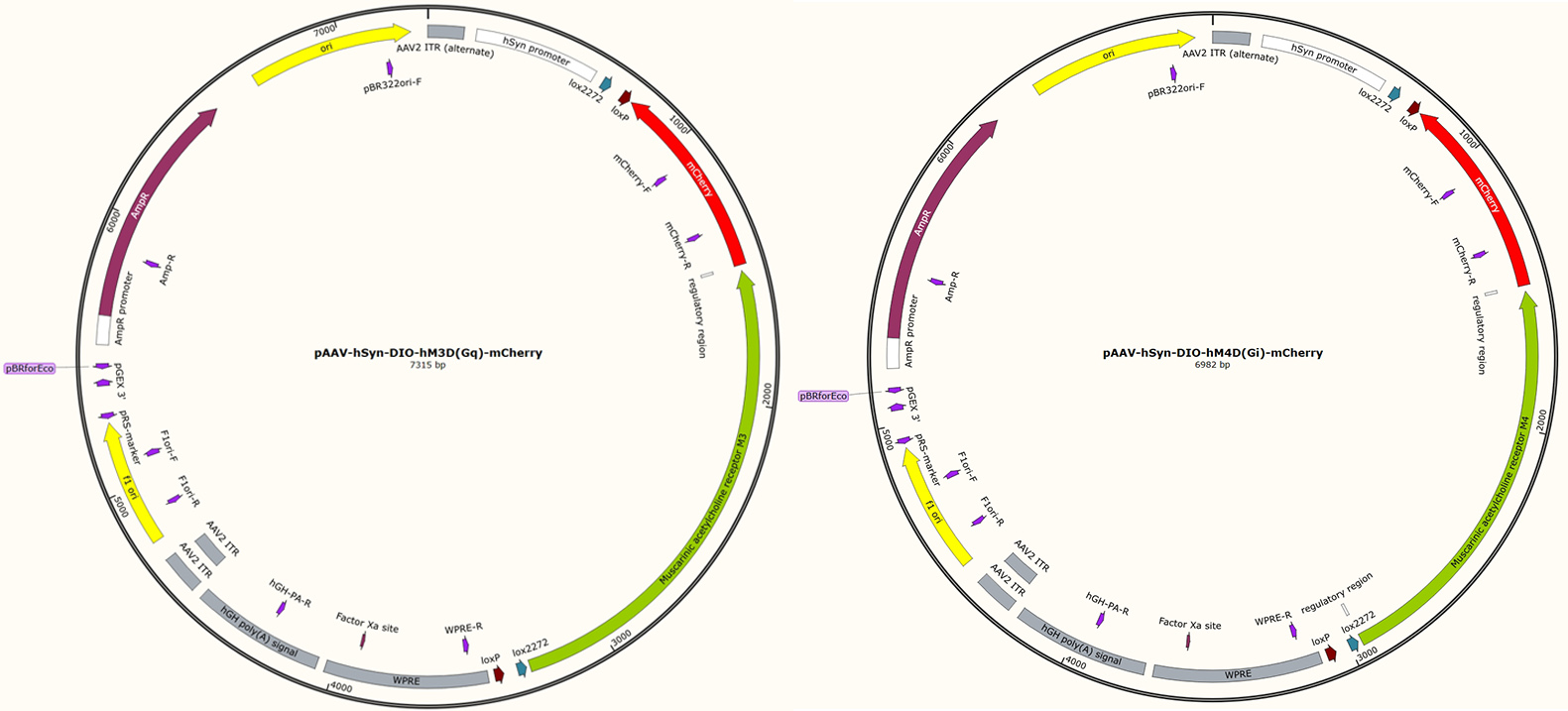
图3 文中用到的两个质粒图谱
基本实验流程:
1. 构建上述两个质粒,分别表达hM3Dq和hM4Di。作者采用了DIO策略,只有在Cre重组酶存在的时候,hM3Dq和hM4Di被成熟神经元特异的hSyn启动子转录表达。
2. 用AAV8血清型的RepCap质粒一起包装AAV病毒
3. 立体原位注射的方式将AAV病毒注射到AgRP神经元特异表达Cre重组酶的小鼠(AgRP-Ires-cre)脑部。
4. 注射CNO,实现对神经元活动的控制。
5. 电生理检测:采用电极记录神经元细胞膜内外电压变化,以此来验证DREADDs受体的有效性。
6. 表型检测:通过实验确认激活或者抑制神经元活动给实验动物造成的影响。
参考文献
Krashes MJ, Koda S, Ye C, Rogan SC, Adams AC, Cusher DS, Maratos-Flier E, Roth BL, Lowell BB. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. J Clin Invest. 2011 Apr;121(4):1424-8. doi: 10.1172/JCI46229. PMID: 21364278; PMCID: PMC3069789.
Souce: 纽普生物 2024-09-11