环状 RNA(circRNA)是一类具有共价闭合单链结构的非编码 RNA,在很长一段时间内被认为不具备蛋白编码潜力。然而,近年来的大量研究证实,部分 circRNA 可突破传统认知,通过内部核糖体进入位点(IRES)等非帽依赖机制启动翻译过程,生成具有生物学功能的蛋白质或多肽,这一发现为 RNA 功能研究及生物制药领域开辟了新的方向。
一、circRNA 的生物发生与分子特征
(一)核心生成机制
circRNA 的生成途径具有多样性,其中真核生物中最主流的方式是在细胞核内通过前体 mRNA(pre-mRNA)的反向剪接(back-splicing)产生。反向剪接的核心是让下游外显子的 5' 剪接位点与上游外显子的 3' 剪接位点近距离靠近,该过程主要依赖两类驱动因素:一是两侧内含子的互配作用,如 Alu 反向重复序列或其他互补序列可直接驱动 RNA 成环;二是蛋白辅助作用,MBL、QKI、FUS、NOVA2 等蛋白形成的二聚体可将 RNA 两端 “拉近” 以促进成环,而 ADAR1 或 DHX9 蛋白的解旋作用则会抑制成环过程。
除反向剪接外,circRNA 还可通过其他途径生成:其一为套索残留机制(lariat escape),当脱支酶 DBR1 未能成功识别 pre-mRNA 剪接产生的套索结构时,套索经修剪后可形成 circRNA(这类 circRNA 被称为 ciRNA);其二为 tRNA/rRNA 加工副产物途径,该途径可产生 tricRNA 以及古菌中的 16S/23S 环状中间体。
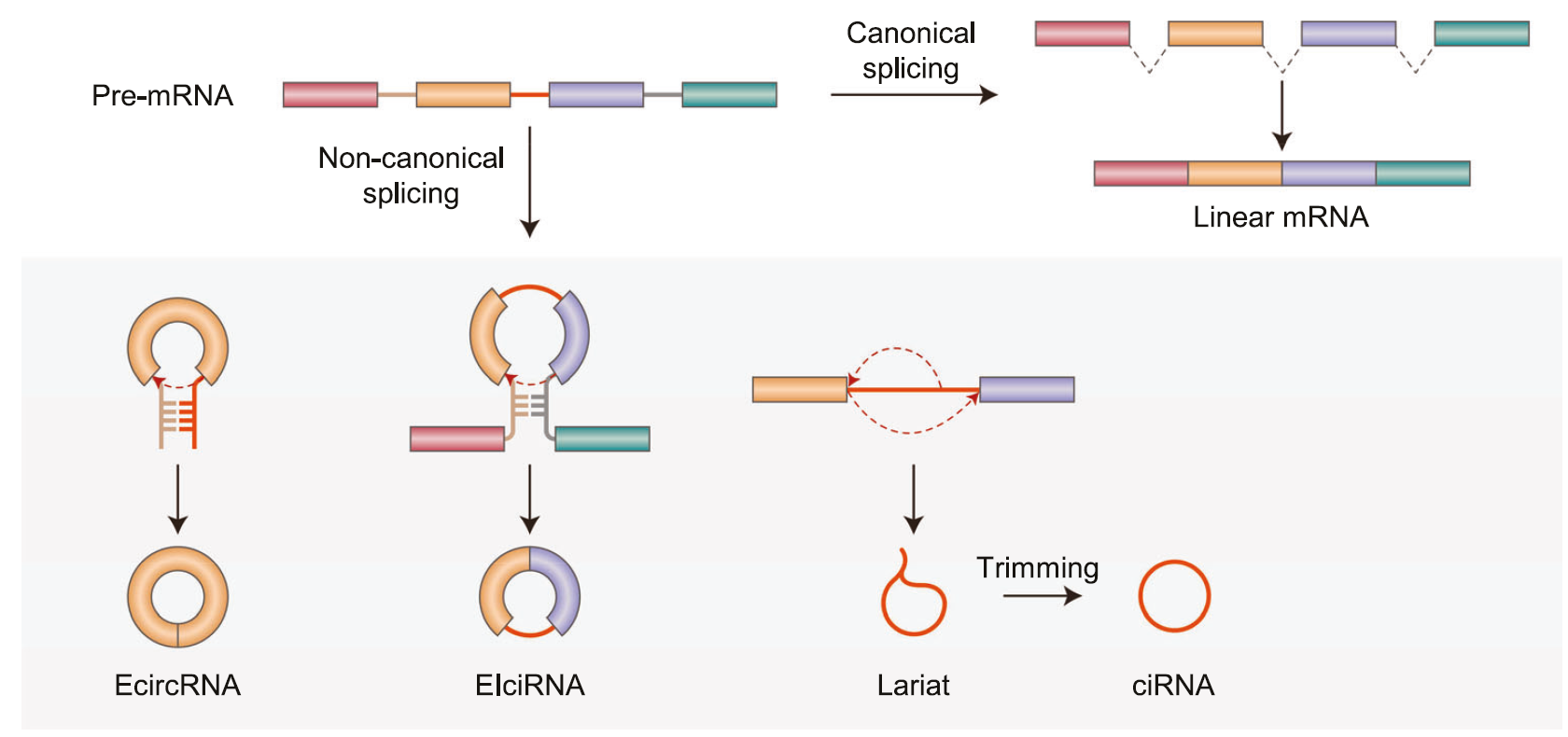
(二)分类与结构特征
根据成熟 circRNA 中是否包含内含子,可将其分为外显子 circRNA(EcircRNAs)和外显子 - 内含子 circRNA(EIciRNAs)。所有类型 circRNA 的化学本质均为共价闭合的单链 RNA,其显著结构特征是缺少 5′-cap(帽子结构)与 3′-poly (A)(多聚腺苷酸尾),这一结构特点赋予了 circRNA 独特的稳定性:
抵抗 3′→5′外切酶(如 XRN1、XRN2)的降解;
抵抗 5′→3′外切酶(如 DOM3Z/Rat1)的降解;
因此,circRNA 的半衰期可达 19–24 小时,而对应的线性 mRNA 半衰期仅为 4–7 小时,这种高稳定性为其发挥长期生物学功能提供了基础。
二、circRNA 翻译的分子机制
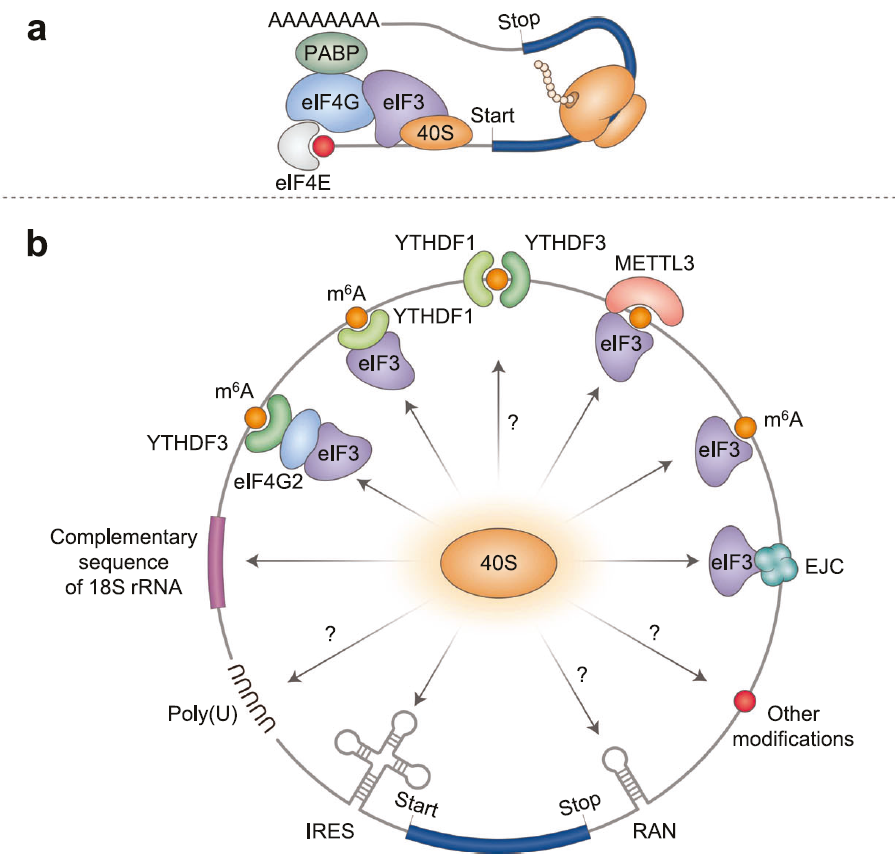
真核生物中 95% 以上的翻译过程依赖 “帽依赖” 途径(上图a):5′-cap 与 eIF4E 结合,再通过 eIF4G 与 3′-poly (A) 结合的 PABP 相互作用形成 “闭环” 结构,进而招募 43S 前起始复合物扫描 mRNA 上的 AUG 起始密码子以启动翻译。由于 circRNA 缺乏 5' 帽子结构和 3'poly (A) 尾,无法通过这一经典途径启动蛋白合成,其翻译依赖内部核糖体进入等非经典机制,核心分子元件和调控因子如下(上图b):
(一)内部核糖体进入位点(IRES)介导的翻译启动
内部核糖体进入位点(IRES)是一类位于 RNA 内部的二级或三级结构元件,能够不依赖 5' 帽子结构直接招募 40S 核糖体亚基,从而启动翻译过程。经典 IRES 最初在病毒基因组 RNA(如小核糖核酸病毒)中被发现,后续研究证实真核生物内源 circRNA 中也存在功能性 IRES。
高通量筛选已鉴定出约 17000 个潜在 IRES 序列,其中与 18S rRNA 互补的序列、茎环结构元件(SuRE)以及多聚尿嘧啶(poly (U))基序等可显著促进 circRNA 翻译。例如,circZNF609 的非翻译区(UTR)包含功能性 IRES,且该 IRES 的活性依赖剪接过程;circPINTexon2 的 IRES 上游存在短开放阅读框(ORF),可编码由 87 个氨基酸组成的功能多肽。此外,短核苷酸串联重复序列可通过重复相关非 AUG(RAN)翻译启动 circRNA 表达,该机制不依赖经典的 AUG 起始密码子,且与多种人类遗传病的发生发展相关。
(二)N⁶- 甲基腺苷(m⁶A)修饰的调控作用
N⁶- 甲基腺苷(m⁶A)是真核生物 mRNA 中最丰富的内部修饰,同样在 circRNA 翻译调控中发挥关键作用,其调控过程依赖一系列特异性分子:m⁶A 甲基转移酶(Writer)包括 METTL3/14 复合物;去甲基化酶(Eraser)包括 FTO 和 ALKBH5;识别蛋白(Reader)包括 YTHDF1/2/3、eIF3 以及 METTL3 本身。m⁶A 的核心基序为 RRACH 或 DRACH(其中 R=A/G、H=A/C/U、D=A/G/U)。
m⁶A 修饰对 circRNA 翻译的调控机制主要包括:YTHDF1、YTHDF3 等识别蛋白可特异性结合 circRNA 中的 m⁶A 位点,进而招募翻译起始因子 eIF3 和 eIF4G2,促进 40S 核糖体通过内部进入方式启动翻译;m⁶A 甲基转移酶 METTL3 可与 eIF3h 相互作用,帮助形成有利于翻译的 mRNA 环状结构,从而增强 circRNA 的翻译效率。此外,m⁶A 修饰在 circRNA 中的分布位置(如 5'UTR 或编码区)会影响翻译起始的效率和特异性,为 circRNA 翻译的精准调控提供了分子基础。
(三)外显子连接复合体(EJC)的介导作用
外显子连接复合体(EJC)是 mRNA 剪接后沉积于外显子 - 外显子连接上游 20-24 核苷酸处的多蛋白复合体,主要由 eIF4A3、Y14、MAGOH 和 MLN51 四种蛋白组成。在 circRNA 通过反向剪接生成的过程中,EJC 可沉积于反向剪接连接位点(BSJ)附近,通过 eIF4A3 与 eIF3g 的相互作用招募 eIF3 复合体和 40S 核糖体,从而启动内部翻译。
研究证实,内源性 circRNA 与多聚核糖体的结合依赖 eIF4A3,而 EJC 组件的存在可显著增强这一相互作用。此外,eIF3j 作为 eIF4A3 的抑制因子,可促进 eIF3 复合体与 circRNA 的解离,进而负向调控 circRNA 的翻译起始过程;eIF4A3 的磷酸化修饰还可影响 EJC 的装载效率,使 circRNA 翻译呈现细胞周期依赖性调控特征。
(四)核糖体结合后的翻译完成过程
40S 核糖体与 circRNA 结合后,还需经历扫描与起始密码子识别、60S 核糖体结合与肽键形成等关键步骤,最终完成蛋白合成:
扫描与 AUG 识别:circRNA 的翻译起始仍遵循 Kozak 语境(核心序列为 gccAUGg),但由于缺少帽依赖途径的 “扫描锁” 机制,非 AUG 启动(如 CUG、GUG、AUA)的发生率为 5–10%,显著高于线性 mRNA。
60S 结合与肽键形成:这一过程与线性 mRNA 的翻译完全一致,但由于 circRNA 为环状结构,没有翻译终止后的核糖体解离信号,因此会出现两种特殊结局:
滚环翻译(Rolling-circle translation):翻译过程无终止信号,核糖体围绕 circRNA 循环移动,持续合成多聚体蛋白;
-1 核糖体移码(-1PRF)逃逸:核糖体在翻译过程中发生滑移,产生异位终止密码子,使多聚体蛋白得以释放,同时避免持续翻译导致的细胞毒性。
三、circRNA 翻译的关键调控因素
(一)开放阅读框(ORF)的结构特征
circRNA 的开放阅读框(ORF)结构直接影响其翻译效率和自身稳定性,其结构由起始密码子(AUG 或非 AUG)、终止密码子(UAA、UAG、UGA)与反向剪接连接位点(BSJ)的相对位置决定:当终止密码子位于 BSJ 下游且 EJC 保留时,circRNA 可被无义介导的 mRNA 降解(NMD)途径识别并降解;若 BSJ 位于终止密码子上游,延伸的核糖体可置换 EJC,使 circRNA 逃避 NMD 降解并稳定存在。
部分 circRNA 缺乏终止密码子,可通过滚环翻译生成高分子量的多聚体蛋白,而 - 1 核糖体移码(-1PRF)机制可产生框外终止密码子,终止持续翻译过程。此外,circRNA 的 ORF 可通过反向剪接形成新的融合序列,编码具有独特功能的嵌合蛋白,例如 circSMO 通过外显子 3-6 的反向剪接形成新 ORF,可编码由 193 个氨基酸组成的嵌合蛋白,该蛋白在相关生理病理过程中发挥特异性作用。
(二)表达系统的优化
传统的 circRNA 表达系统(如 ZKSCAN1 内含子系统、RBP 辅助系统等)存在显著缺陷,不仅生成 circRNA 的效率较低,还易产生超过 95% 的线性 RNA 副产物,严重限制了 circRNA 的应用。Tornado 系统的出现有效解决了这一问题,该系统通过在 RNA 两端引入 Twister 核酶序列,转录后核酶发生自催化切割,再由内源性连接酶 RtcB 介导环化,可在哺乳动物细胞中高效生成 circRNA,真环比例超过 90%,产量较传统反向剪接系统提升 220 倍。
Tornado 系统的优化组合(CMV 启动子 + CVB3 IRES)可实现高水平蛋白表达,且表达产物可包装入病毒样颗粒(VLPs),显著延长蛋白表达持续时间。此外,Pol III 启动子(如 U6)可提高 circRNA 的转录水平,但需对 IRES 进行突变以去除 Pol III 终止信号(如 EMCV IRES 突变体 mutEMCV),从而平衡转录效率与翻译活性。
(三)Tornado 系统的应用最佳实践
基于现有研究,Tornado 系统的优化应用需关注以下关键参数:
启动子选择:CMV 启动子(Pol II)可兼顾转录水平与翻译效率,是通用性优选;U6 启动子(Pol III)虽能显著提高 RNA 产量,但翻译效率较低,适用于特定高转录需求场景。
IRES 选择:不同 IRES 的促进翻译活性存在差异,优先级为 CVB3 > HRV-B3 > EMCV;若采用 Pol III 启动子,需将 EMCV IRES 中的 UUUU 序列突变为 UUCUCU,以避免 Pol III 介导的转录提前终止。
环化柄(stemforming)长度:18 bp 的环化柄已能满足基本环化需求,26 bp 的环化柄效果略优,而 49 bp 的环化柄未显示进一步提升,可通过 mFold 或 RNAfold 等生物信息学工具进行优化设计。
连续翻译(NO-STOP)优化:HCV-IRES 的终止密码子突变后,连续翻译效率仅提升 50%;内源 LIMA1-IRES 的连续翻译效率可提升 90 倍,但绝对值仍远低于 CVB3 IRES,因此 CVB3 IRES 仍是连续翻译场景的优选。
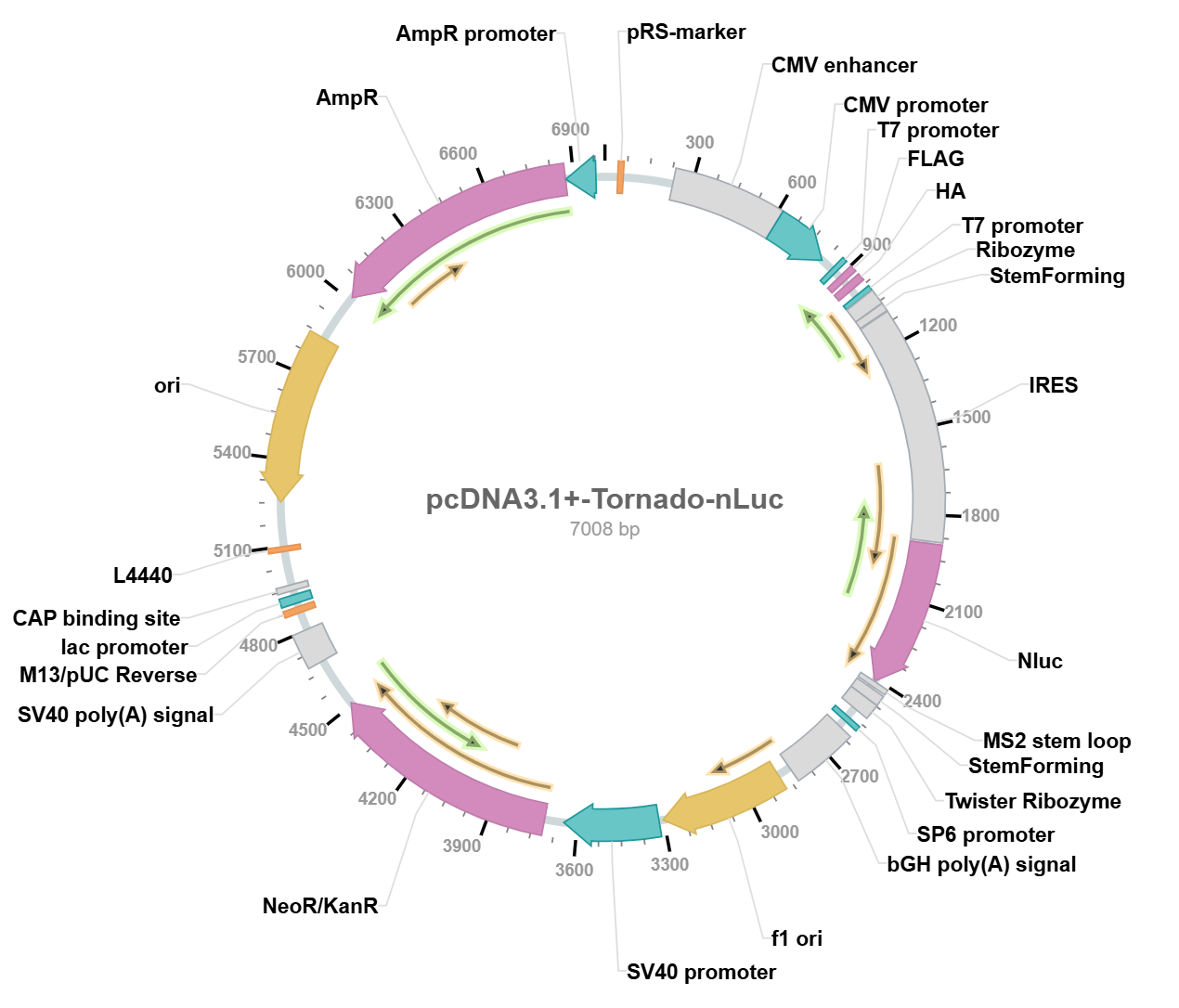
以 pcDNA3.1+-Tornado-nLuc 质粒为例,该质粒全长 7008 bp,其核心结构及工作原理如下:质粒转入哺乳动物细胞后,CMV 启动子启动转录,生成的 mRNA 结构为 “Ribozyme-stemforming-IRES-Nluc-stemforming-Twister Ribozyme”。转录完成后,两个 Ribozyme 发生自剪切并脱离 mRNA,剩余片段的两个 stemforming 区域形成茎环结构(设计时建议每 10 个碱基插入凸起(bulge),可优化茎环结构稳定性,避免过度配对导致的结构僵化);茎环结构使 RNA 两端相互靠近,在 RNA 连接酶 RtcB 的作用下完成环化,形成功能性 circRNA。应用该质粒表达目标蛋白时,仅需将 Nluc 基因替换为目的基因(酶切位点为 BsiWI 和 SacII),需注意的是,为保留茎环结构的完整性,需在 SacII 的 5’端加入 GCCATGTcTATGTGG 序列。
四、参考文献
Unti MJ, Jaffrey SR. Highly efficient cellular expression of circular mRNA enables prolonged protein expression. Cell Chem Biol. 2024 Jan 18;31(1):163-176.e5. doi: 10.1016/j.chembiol.2023.09.015. Epub 2023 Oct 25. PMID: 37883972; PMCID: PMC10841545.
Litke JL, Jaffrey SR. Highly efficient expression of circular RNA aptamers in cells using autocatalytic transcripts. Nat Biotechnol. 2019 Jun;37(6):667-675. doi: 10.1038/s41587-019-0090-6. Epub 2019 Apr 8. PMID: 30962542; PMCID: PMC6554452.
Liu Y, Wilson TJ, McPhee SA, Lilley DM. Crystal structure and mechanistic investigation of the twister ribozyme. Nat Chem Biol. 2014 Sep;10(9):739-44. doi: 10.1038/nchembio.1587. Epub 2014 Jul 20. PMID: 25038788.
Hwang HJ, Kim YK. Molecular mechanisms of circular RNA translation. Exp Mol Med. 2024 Jun;56(6):1272-1280. doi:
10.1038/s12276-024-01220-3. Epub 2024 Jun 14. PMID: 38871818; PMCID: PMC11263353.
Souce: 纽普生物 2025-12-01